摘要
背景:尽管矮身高儿童在刺激试验中GH水平正常而且无其它病因,但矮身高可能与低水平的IGF-I有关。目的:估价以重组IGF-I(rhIGF-I)治疗低水平IGF-I矮身高儿童的有效性和安全性。设计:1年的随机非盲试验。地点:该研究在美国30所儿科内分泌诊所进行。受试者:总计136名有低IGF-I水平的青春期前矮身高儿童(身高和IGF-I SDS均<-2,刺激试验GH≥7ng/ml);其中的124名儿童完成了本研究,6名因不良事件退出,6名因其它原因退出。干涉:肌肉注射rhIGF-I,每天2次,根据体重(40, 80,或120 µg/kg; n = 111)或观察(n = 25)确定剂量。主要结果指标:第一年身高速度(cm/yr),身高SDS,IGF-I和不良事件。结果:在完成实验的受试者中,与未治疗组相比,每天2次80和120µg/kg剂量组第一年身高速度增长(分别为7.0±1.0, 7.9±1.4和5.2±1.0 cm/yr, P < 0.0001);120ug/kg剂量组与80µg/kg组相比,第一年身高速度也增加(P = 0.0002);第一年身高速度与年龄负相关。这种增长均不能由GH刺激试验或IGF-I生成试验所预测,而且与IGF-I抗体状态无相关。所报告的最普遍的不良事件是头痛(38%受试者)、呕吐(25%)和低血糖(14%)。结论:rhIGF-I治疗与依赖于年龄和剂量的第一年身高速度增长相关。治疗过程中的不良事件并不像以前研究的那样普遍,而且一般为短暂的、易于处理且无已知的后遗症。
(J Clin Endocrinol Metab 94: 3721–3730, 2009)
前言
人类和基因敲除动物的突变分析说明,IGF-I为正常生长所必需。IGF-I是GH作用的基本介体,GH缺乏、营养不良、未治疗的甲状腺机能减退或慢性炎症导致IGF-I缺乏。GH作用缺陷,例如GH受体、信号转导和转录激活子5b的突变,或是IGF-I基因突变常常导致严重IGF-I缺乏。但是,在某些临床情况下IGF-I的缺乏并不严重,并无病因表现。在矮身高的评价中,尽管有正常的GH峰水平,但19-25%儿童的IGF-I水平低于5th百分位数(或IGF-I SDS<-2)。
已经在严重IGF-I缺乏病人评价了重组IGF-I(rhIGF-I)替代治疗,并被批准为rhIGF-I的适用症(美国身高SDS≤-3和IGF-I SDS≤-3;欧洲共同体IGF-I<2.5th百分位数,GH正常或升高)。在美国,以rhGH治疗IGF-I低而GH水平正常的某些不太严重的特发性矮身高。但尚未批准使用其它的选项治疗这样的儿童。在理论上,rhIGF-I替代治疗也增加低IGF-I水平矮身高儿童的生长,但尚不了解儿童是否安全地受益于这种治疗。
本研究评价了对低水平IGF-I矮身高儿童(身高和IGF-I SDS<-2,刺激试验GH水平≥7ng/ml)应用rhIGF-I治疗的安全性和有效性。
受试者和方法
受试者
美国30所儿科内分泌诊所随机化的、有低水平IGF-I的137名青春期前矮身高儿童。其中136名受试者有基线后身高测量数据。研究方案得到各中心学术评审委员会批准。在研究开始之前获得父母或全权法律代表的知情同意。
包括/排除标准
包括标准有:身高和IGF-I SDS<-2,刺激试验中GH≥7ng/ml,年龄在3岁以上,生活年龄或骨龄男<12岁,女<11岁。所有受试者进入研究前经乳房和睾丸检查均为青春期前。受试者必须有正常的营养史,甲状腺功能试验正常,BMI大于同年龄、性别的5th百分数。使用研究人员习惯的刺激物进行GH刺激试验。排除标准有:以前以rhGH、rhIGF-I或其它影响生长药物(例如糖皮质激素、性类固醇、促性腺激素激动剂/拮抗剂,或注意力缺乏活动过度疾病药物)进行过治疗的、其它可鉴别病因的生长障碍,例如GH受体突变或GH基因缺失、以及影响治疗结果的慢性疾病,如染色体异常。
研究设计
本研究是一项1年、随机、非盲、观察对照、剂量比较研究,评价以rhIGF-I治疗低水平IGF-I矮身高儿童的安全性和有效性。在筛查后,按照2:3:3的比例受试者被随机分为对照组和两种IGF-I剂量组。剂量依受试者体重计算,每日两次肌注rhIGF-I,开始时两剂量组为40和80 µg/kg,但在证实40µg/kg剂量不能正常化血清IGF-I时,改换为120ug/kg剂量组。因为这种剂量组的暴露时间不同,分别分析开始以40µg/kg剂量的16名受试者,但在本报告中讨论该组的安全性数据。
在20或40 µg/kg剂量开始治疗1个月后,增加剂量,逐渐达到设计剂量。受试者在早餐和晚餐时注射,如果未进餐则不注射,并不得超前注射。使用剂量日记、药瓶计数和定期测量血清IGF-I评价治疗的顺从性。
第一结束点是第一年身高速度(cm/yr),第二结束点是身高SDS的变化和安全性,包括不良事件的监测、实验室检查、抗IGF-I抗体和人体测量学(手脚长度测量)。头围和手脚长度使用相同年龄的平均数和标准差以SDS表示。
筛查后,在基线、1,3,6,9,12个月时对受试者进行评价。在每次研究调查时,测量身高、体重、生命体征、身体和眼底检查,搜集不良事件。要求受试者报告同时发生的头痛与呕吐,以在同一天评价颅内高血压的可能性。
实验室检查
如果可能,研究调查在上午进行,以便能够在用药后2-4小时预期的IGF-I浓度峰时采集血样。在筛选时以及在研究中,进行IGF-I、IGF-II、IGF-结合蛋白-2、IGF-结合蛋白-3、GH结合蛋白的分析。在1年时,最后一次用药后至少禁食12小时,在预期的分析物低谷水平时采集血样。
安全性实验室检查包括,血常规、白细胞分类计数、血清化学、总T4和TSH、胆固醇、禁食胰岛素、和葡萄糖。使用ELISA,筛查治疗前和1年的血清样本抗IGF-I抗体。阳性样本重复检测以证实在ELISA中的结合受到rhIGF-I的特异抑制。
骨龄
使用左手腕X线片评价骨成熟度(骨龄)。研究者根据Fels方法阅读所有X线片,并说明是否符合进入研究标准。
IGF-I生成试验
在随机化分组前,每名受试者接受IGF-I生成试验(每天接受50 µg/kg的 rhGH,共计7天)。在治疗前和第7次给药后的上午采集血样,测量IGF-I和IGFBP-3水平。
统计分析
根据发起者提供的名单使受试者随机化,并由基线身高SDS分层(<-2.6或≥-2.6)。以使120µg/kg组与未治疗组比较有大于95%的统计功效来估计样本大小,假设第一年身高速度差为3.5cm/yr;80与 120µg/kg组比较至少80%的统计功效,假设第一年身高速度差为2.7cm/yr。
基本疗效分析使用在基线时以及基线后至少一次身高测量的所有随机化受试者的目的-治疗组群。以协方差分析(ANCOVA)比较80、120µg/kg组和未治疗组,协变量为基线身高SDS、治疗前身高速度、基线骨龄、生活年龄和性别。使用Dunnett方法调整多重比较,保持总0.05水平的I型误差。二次分析使用相同协变量的ANCOVA,比较80和120µg/kg组。使用方案特定的协变量的ANCOVA,分析身高SDS的变化,确定第一年身高速度与GH刺激试验、IGF-I生成试验和1年时骨龄变化之间的关系。对于完成实验的亚组进行同样的统计分析。所有P值为双尾。
结果
在2004年三月至2007年七月受试者进入研究。随机化受试者总计137名,但有1名受试者在随机化后不久退出。基本疗效分析中有136名受试者(未治疗,n=25;80µg/kg n=44;120µg/kg n=51),单独分析由40µg/kg组转到120µg/kg组的16名受试者。三组的基本特征相似(表1)。所有三组治疗前的身高速度仅适合于维持其不理想的身高SDS。
其中124名受试者完成了研究(未治疗, n = 23; 80 µg/kg, n = 40; 120 µg/kg, n = 45)。12名受试者在完成研究前退出:6名因不良事件,4名为受试者或其父母的选择,2名跟踪丢失。导致退出研究的不良事件包括短暂颅内高血压(n = 2),注射疼痛(n=1),开始治疗注意力缺乏多动症(n=2),以及先天性心脏缺损修复(n=1)。
生长
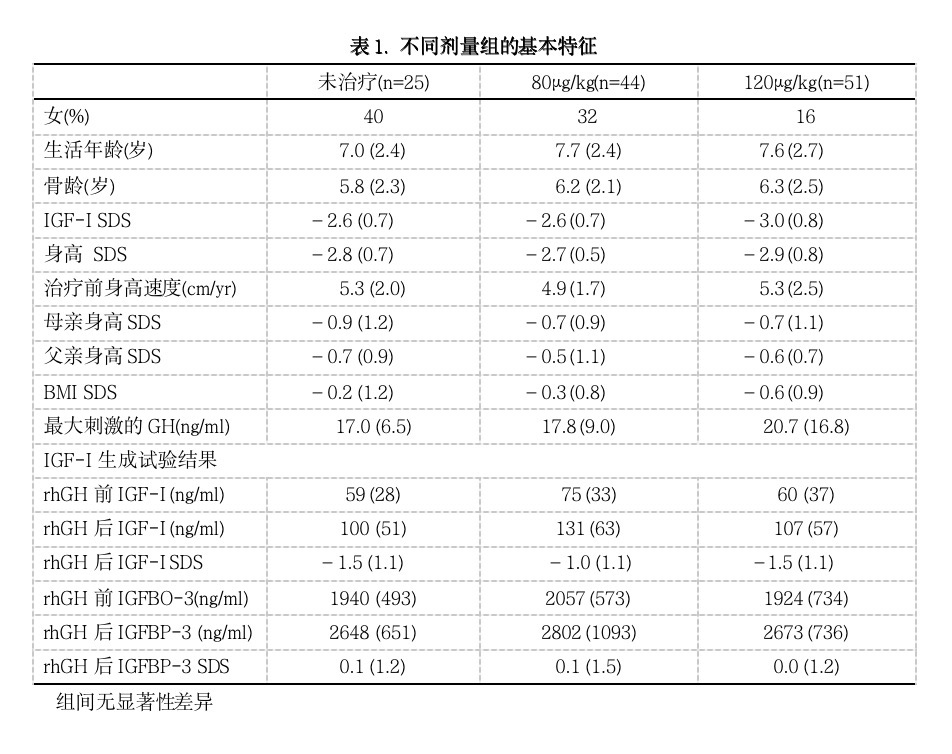
使用目的-治疗组群,80和 120µg/kg组平均第一年身高速度较未治疗组显著增加(分别为6.9±1.0, 7.7±1.5和5.2±1.0cm/yr,与未治疗组比较 P < 0.0001)。这些结果与完成本研究的受试者相一致,80和 120µg/kg组平均第一年身高速度较未治疗组显著增加(分别为7.0±1.0, 7.9±1.4和5.2±1.0 cm/yr, 与未治疗组相比 P < 0.0001;图1A和表2)。与80µg/kg组比较,120µg/kg组的第一年身高速度也显著较高(1.0cm/yr; P = 0.0002;表2)。
第一年身高速度与年龄负相关(ANCOVA, P = 0.0003;图1B和C)。使用协方差模型,第一年身高速度方差的约50%可由剂量和年龄来解释。其它协变量,性别、基线身高SDS或IGF-I SDS、抗体状态、刺激的GH水平或IGF-I生成试验后的IGF-I水平都不能预测第一年身高速度。
在1年时,80和120µg/kg组的平均身高SDS变化显著大于未治疗组(分别为0.4±0.2, 0.5±0.3和0.02±0.2,与未治疗组比较 P < 0.0001;表2)。120µg/kg组的平均身高SDS变化也大于80µg/kg组(P = 0.0071)。未治疗组身高速度较低,与基线相比身高SDS未出现显著性增长。通过检查1年时身高SDS变化与头围、手长和脚长SDS变化之间的差异评价生长均衡性,这些差异的平均数接近零,说明了成比例的生长(表2)。
骨龄
80和120µg/kg组在1年时的平均骨龄变化相似(1.1±0.4和1.2±0.5岁),大于未治疗组的变化(0.8±0.3岁,表2)。当以骨龄的变化调整第一年身高速度比较时,仍然存在rhIGF-I治疗的显著性效果(ANCOVA,与未治疗组比较 P < 0.0001)。
体重指数(BMI)
在1年的治疗中,80µg/kg组的平均BMI SDS无变化,120µg/kg组显著增长(0.3±0.5;P = 0.0021),而未治疗组显著下降(–0.3±0.4, P = 0.0056;表2)。120µg/kg组的平均BMI SDS变化显著大于未治疗组(P = 0.0004)。
青春期发育
在研究过程中13名受试者(12名治疗组,1名未治疗组)进入青春期,女孩乳房Tanner分期≥2(n=5),男孩睾丸体积>3ml(n=8)。除1名(120µg/kg组中的6.6岁女孩乳房开始发育)外,所有受试者在适当年龄上开始青春期。
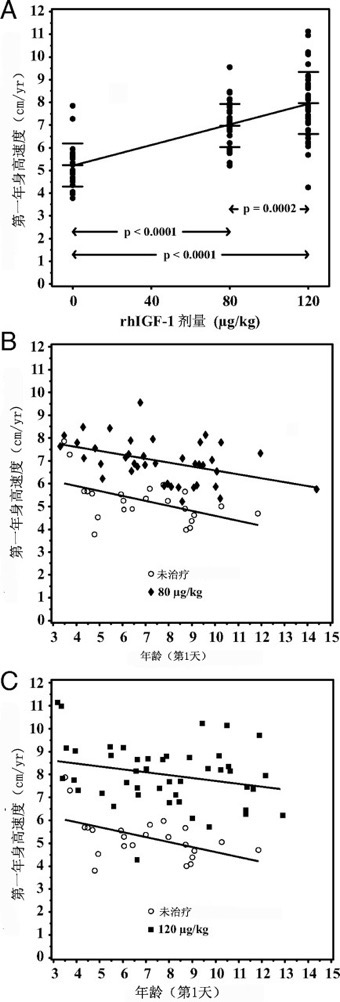
图1. A.受试者第一年身高速度与剂量的比较. B. 80-µg/kg组第一年身高速度与年龄的比较. C. 120-µg/kg组第一年身高速度与年龄的比较.
生长因子
在1个月时,80和120µg/kg组在接近血清IGF-I峰值时取样测定的平均IGF-I SDS较基线增加(1.1±1.2和1.4±1.5, P < 0.0001)。在3个月和6个月达到了完全设计剂量时,治疗组平均IGF-I SDS约为+2,在1年时,80和 120µg/kg组在低谷时的平均IGF-I仍然显著高于基线水平(分别增加2.0±1.7 和2.2±1.3,P < 0.0001;表2和图2),而在研究中未治疗组的平均IGF-I SDS保持不变。
在1年时,80和120µg/kg组平均血清IGFBP-3(每组均为–19%)、IGF-II(分别为–38和–37%)低于基线水平,而IGFBP-2则高于基线水平(分别为58和61%)。
IGF-I生成试验
在给以rhGH 7天后,所有受试者IGF-I生成试验前后平均血清IGF-I浓度由65.5±33.0 ng/ml增加到114.5±58.0 ng/ml;IGF-I SDS由–2.5±0.9增加到–1.3±1.1。平均血清IGF-I浓度变化约为使用相同治疗计划的另一项研究中健康青春期前儿童的25%。
安全性
在研究中90%以上的受试者至少报告了一种不良事件。大部分不良事件为短暂的,并与药物无关。这些不不良事件很容易处理,仅偶尔导致停止治疗,而且没有已知后遗症。以前的研究曾发现几种与IGF-I暴露有关的不良事件,因此,在本研究中给以了特别的关注(表3)。大部分常见不良事件有,头痛、低血糖和呕吐。头痛和呕吐是普遍的,可能提示了某些未经证实的颅内高血压。但是,仅在6名儿童同时出现了头痛和呕吐:2名经证实为颅内高血压,2名的症状不足24小时,不可能是颅内高血压;另外2名的症状为间歇性的。有几种不良事件治疗组显著多于未治疗组,包括肠胃炎(23%0%, Fisher精确检验 P = 0.0040),头痛(38%与16%, P = 0.038),呕吐(25%与4%, P = 0.016)。头痛或呕吐的出现与事件当天的剂量、24小时平均血清IGF-I SDS之间不存在明显的关系。
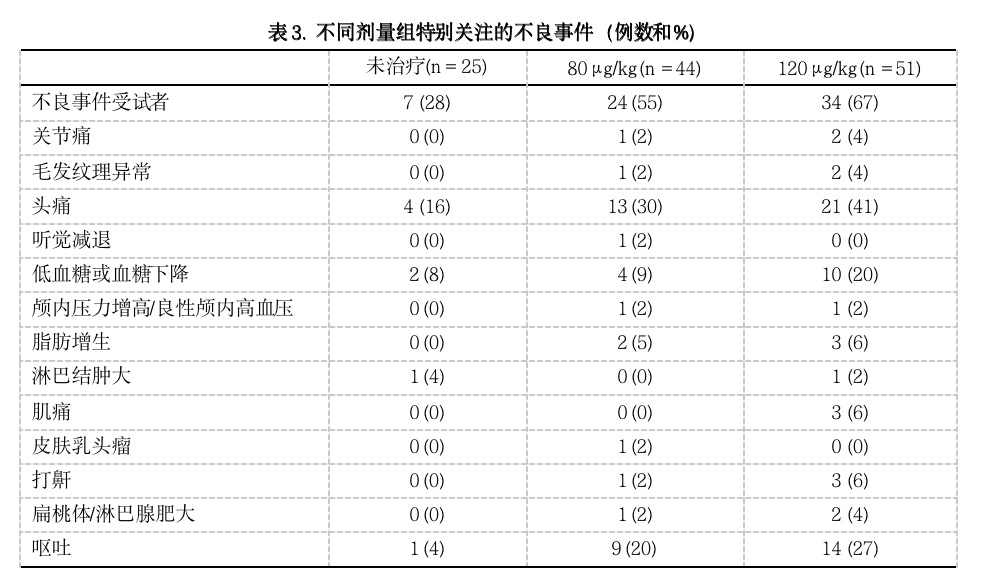
如果测量血糖浓度下降(<50 mg/dl),或通过摄取食物症状减轻或消失的,报告为低血糖。在本研究中,111名治疗者中有16名(14%),25名未治疗者中有2名(8%)可能有低血糖或葡萄糖浓度降低(表3)。在低血糖、事件当天的剂量、24小时平均血清IGF-I之间不存在明显的关系(图3),但在治疗初期比后期更可能出现低血糖。经过证实的低血糖很少,在第1,3,6,9个月搜集的419次测量数值中,未发现非禁食毛细血管血葡萄糖低于50 mg/dl的现象。有3例禁食葡萄糖值低于50 mg/dl,未治疗组1名受试者在随机化前、1年时有无症状的低血糖,治疗组1名受试者在1年时低血糖。
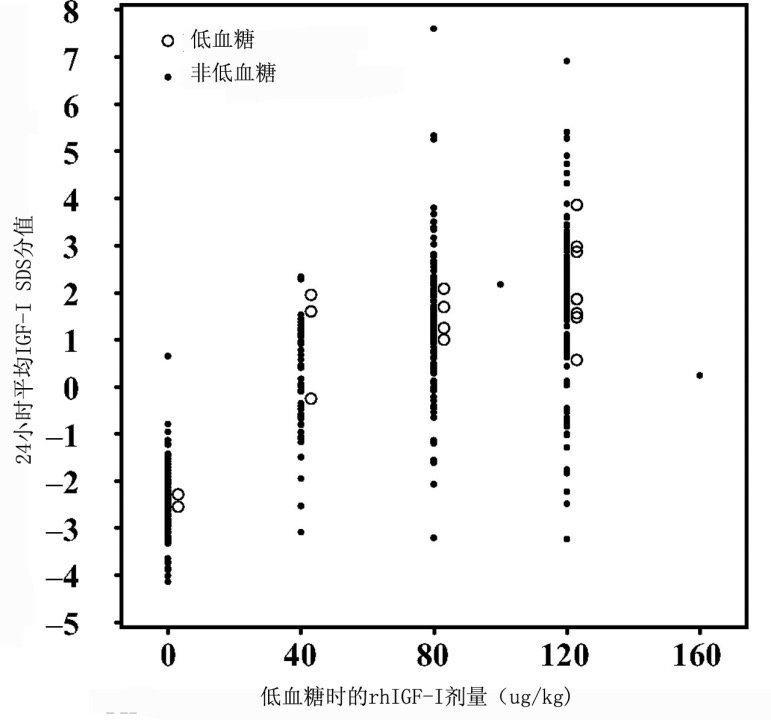
图3. 低血糖、rhIGF-I剂量、24小时平均血清IGF-I浓度之间的关系.
(估计的24小时平均血清IGF-I浓度为接近IGF-I峰值浓度的88%。)
在9名受试者报告了11次严重不良事件:111名治疗受试者中有8名,25名未治疗者中有1名。4名受试者的5次严重不良事件可能与药物有关:2名受试者有颅内高血压,表现为头痛、呕吐和视神经乳头水肿;1名受试者还报告伴随有脱水。1名受试者因呕吐和脱水而住院一夜(无头痛或视神经乳头水肿)。1名受试者因晚间注射后不久超前注射,引起夜间“发作”样行为。所有4名受试者完全恢复并无与事件相关的后遗症。其它严重不良事件与药物无关,包括三房心(n=1),肠胃炎(n=3),肺炎(n=1),面部蜂窝织炎(n=1,非治疗组)。
在治疗程中,平均收缩压和舒张压未变化,80和120µg/kg组在1月和3月时平均脉率比基线有轻微的增加,约增加10次/分,此后恢复到治疗前水平。
在实验室检查中未鉴别出新的安全性症状。虽然有几名治疗受试者出现暂时性(通常在第1个月内)和轻度异常血清转氨酶数值,但所有分析物的平均值与同龄健康受试者相似。尽管平均值仍然在正常范围之内,但基线至1年时的血尿氮、血清肌酸酐和血小板计数显著下降,红细胞压积、血红蛋白和碱性磷酸酶增加(所有均P < 0.01)。未治疗的受试者无显著性变化。未治疗受试者和所评价的87名治疗者中的27名受试者(31%)在1年时有可检测的IGF-I抗体,然而对第一年身高速度无明显影响。
讨论
以rhIGF-I替代治疗IGF-I水平低而GH水平正常的矮身高受试者,第一年身高速度和身高SDS变化以依赖于年龄和剂量的形式显著增长。剂量-反应曲线无明显平台现象,在以骨龄调整身高变化后仍然存在剂量效应。但是,说rhIGF-I治疗可改变成年身高还为时过早。目前,正在进行扩展的长期临床试验研究,可对此问题提供某些答案。少数治疗的受试者在治疗1年时出现可检测的IGF-I抗体,但对第一年身高速度无明显影响。在血清IGF-I浓度峰值接近同龄正常儿童97th百分位数时,出现第一年身高速度增长。120µg/kg剂量组的BMI SDS增加,而非治疗组下降,提示值得进一步研究rhIGF-I对身体组成的影响。以前的研究曾经提出,rhIGF-I治疗可能加速青春期发育,但在我们研究中,除1名以外的所有受试者均在适当的年龄上开始青春期发育。本文中治疗开始几个月的脉率比基线时轻微增加,与rhIGF-I治疗GH受体缺失儿童的报告相似。
在本研究的IGF-I生成试验中,7天rhGH处理引起低IGF-I矮身高儿童血清IGF-I的平均变化约相当于健康青春期前儿童的25%。这个结果提示,低IGF-I而GH水平正常的矮身高儿童可能具有一定程度的GH不敏感性,表现出抵抗GH作用的特征。最近的研究表明,IGF-I缺乏的临床表达可能是由GH不敏感连续谱所致,而不是以前严重GH受体缺陷研究所提出的完全或无的表现形式。特定GH受体基因突变,例如假外显子6突变,引起由典型的GH不敏感性综合症至正常的表型范围。某些GH突变的杂合性,甚至在一个家庭内,也可能产生明显的GH不敏感性连续谱。这种异质性可能导致IGF-I缺乏的连续谱,其范围由严重缺乏(严重原发性IGF-I缺乏,身高和IGF-I SDS≤-3,包括最严重受累的Laron综合症)至低水平IGF-I的矮身高(身高和IGF-I SDS<–2)和接近正常的受试者。
本研究中以rhIGF-I治疗的受试者,第一年身高速度与以rhIGF-I治疗的严重原发性IGF-I缺乏(8.0 cm/yr,每天2次40–120µg/kg剂量)和青春期前特发性矮身高儿童(7.3–8.6 cm/yr,rhGH剂量相当于33–53 µg/kg/d)相似。但是,以rhIGF-I治疗的低水平矮身高儿童和以rhGH治疗的特发性矮身高儿童的第一年身高速度低于以rhGH治疗的GH缺乏儿童的平均身高速度(≥10cm/yr)。每天两次给以IGF-I抑制了夜间GH分泌,可能影响了所观察到的身高速度,而且,本研究中以rhIGF-I治疗的第一年身高速度似乎低于以前所报告的严重原发性IGF-I缺乏儿童。
本研究中的许多重要不良事件发生率低于以类似rhIGF-I剂量治疗的严重原发性IGF-I缺乏受试者,本文中的第一年低血糖事件并不普遍(14%与42%)。本研究中的毛发纹理、扁桃体肥大、打鼾和面部特征粗糙发生率也较低。但头痛和呕吐是普遍的,其原因尚不清楚。本研究中头痛和呕吐同时出现说明还有未报告的颅内高血压案例。在长期研究中将继续监测这些不良事件的发生率,但可能最终依赖于开始rhIGF-I治疗时IGF-I缺乏的严重程度或是治疗暴露的持续时间。
结论,在这些低IGF-I而GH水平正常的矮身高儿童,每天2次给以rhIGF-I,以剂量依赖方式显著增加了第一年身高速度和身高SDS。第一年身高速度的预测因素为基线时年龄和剂量。在这些受试者中,以rhIGF-I治疗一般是安全的、完全可以耐受的。不良事件普遍存在,但是暂时的并易于处理,很少导致治疗中止,而且无已知的后遗症。不良事件发生与剂量或IGF-I水平之间不存在明显的关系。
【金骨龄】专业骨龄及生长发育研究机构,中国骨龄行业标准制定者张绍岩教授任首席科学家,致力于提供适合中国当代少年儿童的骨龄评价技术和生长发育评价服务,独立研发了适用于医疗、体育、司法及母婴行业的骨龄软件 !
【热门文章推荐】

