摘要:
54名小于孕龄儿(SGA)出生的矮身高儿童参加随机化、双盲、剂量反应实验研究,评价长期连续生长激素治疗对成年身高(AH)的剂量反应效果。将病人随机匿名分为3IU(组A)或6IU(组B)GH/m2/d(~0.033或0.067mg/kg/d)剂量治疗组,平均出生身长为-3.6±1.4SDS,开始研究时的年龄为8.1±1.9岁,开始研究时的身高SDS为-3.0±0.7。54名病人中的17名为部分GH缺乏(刺激试验GH峰,10-20mU/l)。15名未治疗的非GH缺乏的SGA矮身高作为对照组(出生身长-3.3±1.2,开始治疗年龄为7.8±1.7岁,开始治疗时身高-2.6±0.5)。组A和组B的平均AH分别为-1.1+0.7和-0.9+0.8,平均身高SDS分别增长1.8±0.7和2.1±0.8。组A和组B之间的AH SDS(0.3 SDS;95%置信区间-0.2, 0.6;P > 0.2)和身高SDS的增长(0.3 SDS;95%置信区间-0.1, 0.7;P > 0.1)无显著性差异。当以靶身高修正后,组A和组B平均修正的AH SDS分别为-0.2(0.8)和-0.4(0.9)。对照组平均AH SDS(-2.3±0.7)显著低于GH治疗组(P < 0.001)。多元回归分析得出的AH SDS预测变量为:靶身高SDS、身高SDS、研究开始时的生活年龄减骨龄。GH剂量没有显著性影响。结论,对未出现持续赶上生长的SGA矮身高儿童长期连续GH治疗,甚至3 IU/m2/d (0.033 mg/kg/d)的GH剂量,导致了AH的正常化。
J Clin Endocrinol Metab, 2003, 88(8):3584-3590.
前言
小于孕龄儿(SGA)出生可能有重要后果,不仅成年身高(AH)低于-2 SDS的风险显著增加,而且2型糖尿病和心血管疾病的风险也增加。至今尚不清楚对于持久矮身高的SGA病人是否也是如此,因为目前尚未在出生后完全赶上生长的与持久矮身高的SGA之间进行区分。
在生命的头2年中,约15%的SGA出生的儿童未赶上生长而身高不能达到-2 SDS以上。其中的大部分达到的AH在-2 SDS以下。这些儿童持续矮的原因不完全清楚。60%的SGA矮身高儿童在24小时GH测定中有低血浆GH水平,但是发现GH治疗中生理水平的GH与生长反应之间无相关。对于持久性矮身高有几种理论解释,有人提出是生长因子敏感性下降;也有人提出可能受到子宫内程序性改变或遗传背景的影响。最近研究证实,对SGA矮身高儿童的5年GH治疗导致儿童期身高的正常化。然而,尚无研究报告长期连续GH治疗后的AH结果。
在本文中,我们报告了随机化、双盲、剂量-反应实验中的54名SGA矮身高儿童的AH,评价了以3或6 IU GH/m2/d (0.033或0.067mg/kg/d)剂量长期连续GH治疗的效果和安全性。
受试者和方法
研究组
79名青春期前的SGA矮身高儿童参加多中心、双盲、随机化的剂量-反应实验,其中因下列原因6名儿童丢失:尽管出现赶上生长但缺乏动机(n=4),治疗性早熟(n=1),出现GH不敏感性的生化征兆(n=1)。因为这6名儿童未能跟踪,所以分析中不包括他们的数据。在其余的73名儿童中,54名儿童达到了AH,因而本文对他们的数据进行评价,其余19名儿童尚未达到AH而没有包括。达到AH的儿童在开始GH治疗时的年龄比未达到AH儿童约大3岁(8.1±1.9对5.4±1.9岁;P < 0.001),但开始治疗时的其它临床特征相似,表1。
剂量-反应实验评价3和6 IU GH/m2体表面积/d (0.033 or 0.067 mg/kg/d) 两种剂量对长期生长及最终达到的AH的效果。包括的标准为:1)出生身长SDS低于-1.88,2)开始研究时CA男孩在3-11岁、女孩在3-9岁,3)CA的身高SDS低于-1.88,4)CA的身高速度(HV)SDS≤0以排除自发赶上生长的儿童,5)处于青春期前发育阶段(女孩乳房Tanner等级I和男孩睾丸体积<4ml),6)新生儿期无并发症(无严重窒息症状,无新生儿脓毒病,无长期呼吸性通气并发症)。排除的标准为:内分泌或代谢性疾病、染色体疾病、由其它疾病(清感剥夺、严重慢性疾病或软骨发育不全)或综合症(Silver-Russell综合症除外)引起的生长障碍,以前或目前应用干扰GH治疗药物的病人。在79名病人中,27名有部分GH缺乏(GHD,以两次GH刺激试验和一次刺激试验和24小时GH测定中最大GH分泌峰在10-20mU/l确定)。
实验验研究开始于1991年,得到荷兰四个治疗中心的伦理委员会的批准,出于伦理的考虑,未批准在AH前使用对照组。由父母或儿童监护人得到知情同意书。
对照组
在与GH治疗组(1980-1989)同时期的1990年,在三所大学医院出生的107名出生身长低于-1.88 SDS的儿童,参加一项2岁时矮身高SGA儿童自然生长研究,有59名儿童由于开始GH治疗(n=21),性早熟治疗(n=1),痉挛性截瘫(n=1),或缺乏动机或移居国外(n=36)而丢失。在本实验研究进行过程中,有29名儿童符合包括标准,持久矮身高而无赶上生长征兆(HV SDS, <0),但因他们的儿科医师未参加本GH实验研究而仍然未能治疗。这些儿童均无GH缺乏,跟踪这一组儿童作为本文对照组。在2001年,15名儿童达到AH,作为54名治疗组儿童生长和AH的对照。
剂量-反应实验设计
在以CA和24小时GH测定中GH的自然分泌分层后,将79名儿童随机、匿名分为两剂量组:组A,3 IU/m2/d;组B, 6 IU/m2/d (分别为0.033或0.067 mg/kg/d)。研究由1991年4月开始至1993年1月,每日就寝时皮下注射生物合成的生长激素。每3个月根据体表面积调整剂量。为了保证双盲设计,使用配制的同等体积的制剂。
生长评价
在研究中,每3个月一次,由一名医生检查测量所有的儿童,每次随访以Harpenden测距仪测量4次身高,取平均数进行分析,身高以CA的SDS表示(年龄身高SDS)。以荷兰参考标准计算男女儿童靶身高(TH)加长期趋势3cm:1/2 x(父身高+母身高±12) + 3 。使用荷兰参考标准,TH和体重指数(BMI)以SDS表示,靶身高的范围定义为平均TH±2 SD。有一名研究者使用TW2方法评价骨龄(BA),骨成熟度以BA变化/CA变化的比值表示,以CA减BA计算二者差值。由一名研究者根据Tanner方法评价女孩发身等级,男孩使用睾丸仪测量体积。青春期发身开始定义为女孩乳房Tanner等级II,男孩睾丸体积4ml。
AH的确定
GH治疗组的AH定义为前6个月中生长速度低于0.5cm和女骨龄≥15岁、男骨龄≥16.5岁。AH在GH治疗过程中或在停止治疗后追踪的2年内达到。以AH SDS减去TH SDS计算修正的AH。在达到AH或在近AH时病人决定停止GH治疗,近AH定义为前6个月中HV在0.5-2cm之间。对于对照组,AH定义为CA和/或BA男18岁、女16岁时的身高
生化参数
在开始GH治疗前和停止治疗后,进行标准的精氨酸耐受性实验(arginine tolerance test,ATT)。在开始GH治疗时和GH治疗6年后进行葡萄糖耐受性试验。在开始GH治疗和剂量-反应实验中另采集血样,测定血浆IGF-I水平和血红蛋白A1c水平,在开始GH治疗时和第一年、第二年和第五年后测定血浆IGFBP-3水平。在离心后,冰冻保存备测。
激素测定
使用RIA方法测量血浆GH、IGF-I、IGFBP-3和胰岛素,所有指标在同一实验室进行。因为血浆IGF-I和IGFBP-3水平依年龄性别而不同,所以使用相同实验室健康儿童参考值将数值转换为SDS表示。
统计分析
为保持在达到AH前的双盲设计,在使研究者不能识别个体病人的情况下,由一名统计人员独自完成统计分析和结果总结。数据以平均数和标准差表示,使用配对t检验,检验连续变量差异。使用单样本t检验来检验研究过程中不同时间点上零与SDS值之间的差异,使用两样本-t检验,检验组间差异。计算以GH剂量调整后的连续变量之间的相关系数。使用多元回归分析构建预测AH SDS预测模型,检验的变量有GH剂量、TH SDS、开始治疗时的身高SDS、开始治疗时的CA-BA、出生身长SDS、性别、开始研究时年龄、第一年的骨龄、青春期开始年龄、开始时BMI SDS。P < 0.05为显著性水平。
结果
GH实验
组A和组B分别在平均GH治疗7.9±1.7年和7.5±1.7年时达到AH。全组和54名达到AH的儿童治疗前的临床数据见表1。除了年龄外,两组开始治疗时的临床特征相似。
AH
组A(3 IU/m2/d)和组B(6 IU/m2/d)GH治疗的平均AH SDS分别为-1.1±0.7和-0.9±0.8,表2。两组的AH SDS都显著高于开始治疗时的身高SDS (P < 0.0001),两组间的AH SDS差异未达到统计学显著性(平均差值 0.3 SDS;95%置信区间(CI), -0.2, 0.6;P = 0.3)。图1给出了开始治疗时、治疗2年和5年后、AH时的身高SDS和开始至AH的身高SDS增长。组A(开始时-2.9±0.8至-1.1±0.7)与组B(开始时-3.0±0.7至-0.9±0.8)相比,开始至AH的平均身高SDS增长无显著性差异(差值0.3 SDS;95% CI,-0.1,0.7;P = 0.1)。表2列出了研究过程中的身高SDS、TH SDS、AH SDS和修正的AH SDS(AH SDS减TH SDS)。组A的TH SDS(-0.9±1.0)几乎显著地低于组B(-0.5±0.9;平均差值为0.5,95% CI为0.1,1.0;P = 0.08),结果组A(-0.2±0.8)和组B(-0.4±0.9)之间修正的平均AH SDS无显著性差异(平均差值 0.2;95% CI,-0.2, 0.7;P = 0.2)。图2为研究中不同时间点上修正的AH SDS,在GH治疗开始时和2年后,组A和组B修正的身高SDS显著小于0(分别为P < 0.001和P < 0.001)。在AH时,组A修正的身高SDS与0相似,但组B低于0(P < 0.05)。对于男孩,组B的TH SDS和AH SDS显著高于组A(P < 0.01, P < 0.05)(表2);但对于女孩,组A和组B之间的TH SDS和AH SDS无差异(P < 0.05)。
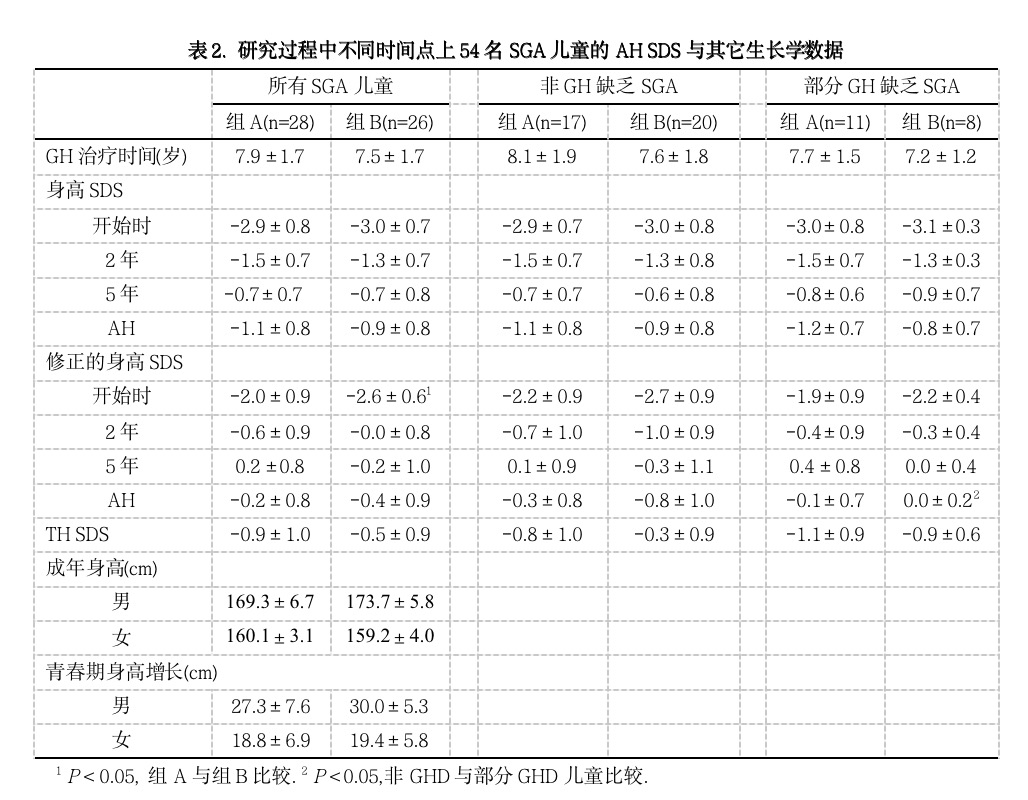
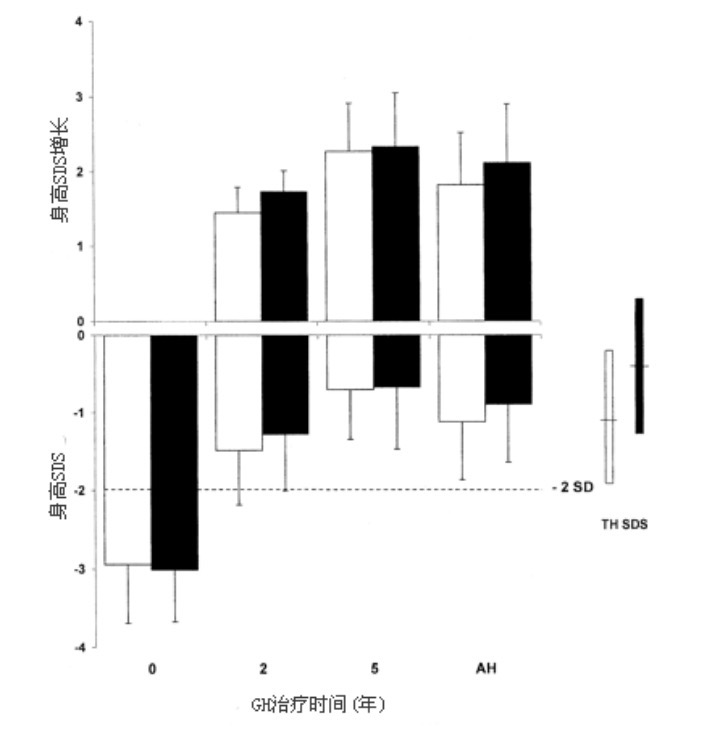
图1. 下图为GH治疗过程中和AH时身高SDS;
上图为治疗开始至2年、5年、AH时的身高SDS增长(□组A,■组B)。
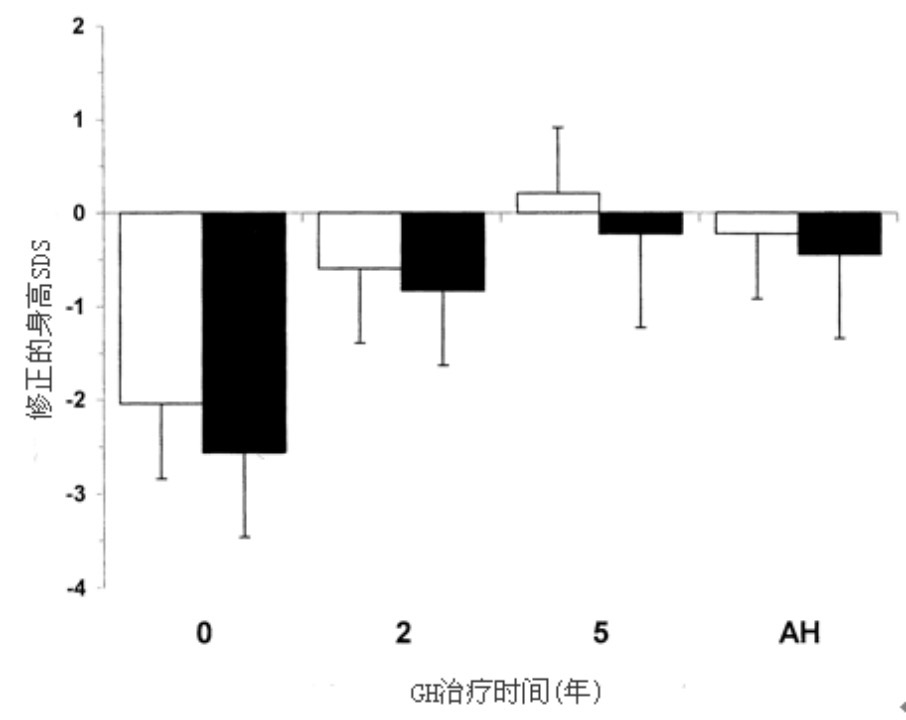
图2. 组A(□)和组B(■)治疗过程中和AH时修正的身高SDS
非GHD与部分GHD的SGA儿童AH的比较
组A和组B中非GHD儿童的AH SDS(分别为-1.1±0.8和-0.9±0.8)与两组中的部分GHD儿童(分别为-1.2±0.7和-0.9±0.7)相似(表2);组A和组B中非GHD儿童平均身高SDS增长(分别为1.9±0.8和2.1±0.8)也与两组中的部分GHD儿童(1.8±0.5和2.2±0.6)相似。非GHD和部分GHD的SGA儿童之间,以GH剂量和TH SDS修正的AH SDS和身高SDS增长无显著性差异。
青春期
组A和组B男孩青春期开始年龄分别为11.7±0.9岁和11.8±0.7岁;女孩分别为10.9±1.1岁和10.8±1.1岁,剂量组之间无显著性差异(均为P > 0.1)。组A和组B中男孩达到AH的年龄分别为16.8±0.9岁和16.9±1.1岁;女孩分别为14.8±0.8岁和15.1±1.2岁,不同GH剂量组间达到AH年龄也无显著性差异(均为P > 0.1)。组A和组B中男孩青春期持续时间(青春期开始至AH)分别为5.1±1.2年和5.2±1.0年;女孩分别为3.9±1.0年和4.3±1.1年。
骨成熟度
无论GH剂量多少,研究期间以每年BA/CA表示的平均骨成熟度变化显著大于1。在GH治疗的第1年,组A和组B骨成熟度变化中位数(范围)分别为1.5 (0.6–2.7)岁和1.1(0.2–3.2)岁;在治疗的第4-5年,组A和组B骨成熟度变化分别为1.1(0.3–2.5)岁和1.0(0.3–2.2)岁,由第5年至停止GH治疗时组A和组B的骨成熟分别为1.0 (0.3–1.6)岁和1.1 (0.4–1.7)岁。在GH治疗开始时、第5年时以及停止治疗时的CA与BA平均差值(CA - BA)分别为0.5±1.1岁, -1.0±1.1岁,和-1.1±1.1岁,组A与组B之间无显著性差异。
GH, IGF-I和IGFBP-3
达到AH的非GHD SGA儿童在开始GH治疗时,GH刺激试验的最大GH峰为28.7 ±11.5mU/l,在24小时GH测定中的GH峰为37.2±16.1mU/l,平均IGF-I SDS为-0.5±0.8。达到AH的54名SGA儿童中,17名儿童的最高GH峰在10–20 mU/l之间。在这些部分GHD儿童,刺激试验中GH峰、24小时GH测定中GH峰、开始治疗时IGF-I SDS平均数分别为13.0±5.8mU/l、 20.9±8.5mU/l和 -1.8±1.2,均低于非GHD SGA儿童(分别为P < 0.001, P < 0.01和 P < 0.001)。
以前曾经报告了5年GH治疗中全组的IGF-I SDS和IGFBP-3 SDS的变化。在停止GH治疗时,组A和组B的平均IGF-I SDS分别为1.0 ±1.1和1.3±1.2,均与0之间存在显著性差异(P < 0.001);组A和组B的平均IGFBP-3 SDS分别-0.8±0.9和-0.06±0.7,仅组A与0之间存在显著性差异(P < 0.001)。在停止治疗时,仅IGFBP-3 SDS的组间差异存在显著性(P < 0.01)。
AH的预测因素
虽然组A和组B之间的AH SDS 和身高SDS增长无显著性差异,但仍然将两组合在一起计算了以GH剂量调整后的相关系数。AH SDS与开始GH治疗时的身高SDS(r = 0.49; P < 0.001)、TH SDS(r = 0.49; P < 0.001)和治疗前HV SDS(r = 0.32; P < 0.05)正相关。AH SDS与下述变量无显著性相关:开始治疗时的CA和BA、出生身长SDS、ATT中的最大GH峰、24小时GH分泌特征、治疗开始时的IGF-I SDS以及GH第一年中的IGF-I SDS。
开始GH治疗至AH期间,身高SDS的增长与治疗开始时的CA和BA负相关(分别为r = -0.36; P < 0.01和 r = -0.46; P < 0.01)。出生身长SDS、TH SDS、治疗前HV SDS、开始GH治疗时IGF-I SDS、IGF-I SDS的增长、ATT中的平均最大血浆GH反应、24小时GH分泌特征与开始GH治疗至AH期间身高SDS的增长无显著性相关。
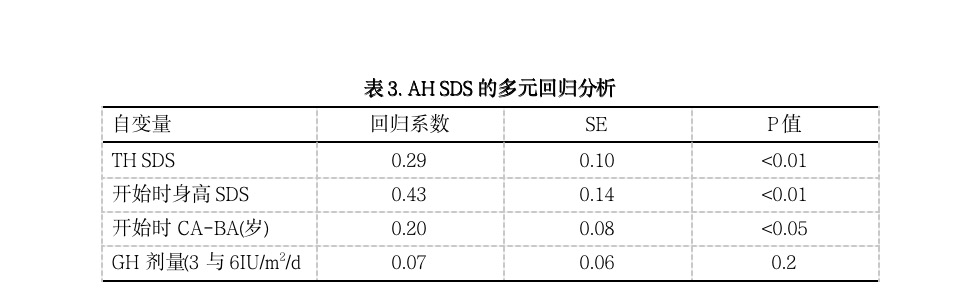
多元回归分析表明,使用变量TH SDS、开始GH治疗时的身高SDS、开始GH治疗时的CA-BA、以及GH剂量说明了AH SDS变异的42%(残数标准差=0.60),表3为多元回归分析结果。对AH SDS无显著性影响的变量为性别、开始治疗时的CA、第一年中的骨成熟度、青春期开始年龄、开始治疗时的BMI SDS、出生身长SDS和GH剂量。
安全性
治疗是完全能够耐受的,未检测出与GH治疗相关的不利事件。最近,我们研究组发表了关于6年的口服葡萄糖试验中空腹和刺激的葡萄糖、胰岛素水平的研究结果,简而言之,连续6年的GH治疗对葡萄糖水平无不利影响。GH治疗引起较高的空腹胰岛素水平和葡萄糖刺激的胰岛素水平,说明了相对的胰岛素抵抗。未发现GH剂量组间的显著性差异。所有儿童均未出现糖尿病。
对照组
对照组15名儿童(5男,10女)平均出生身长SDS -3.3±1.2、出生体重SDS -2.7±0.7、平均孕龄34.3±2.3周。在进入对照组时平均年龄7.8±1.7岁、身高SDS -2.6±0.5、TH SDS -1.1±1.0、修正的身高SDS -1.5±0.9。除了孕龄之外,在GH治疗组与对照组之间未发现治疗前临床特征的显著性差异。
GH-治疗组与对照组的AH
在平均追踪7.5±1.2岁后,对照组达到的AH SDS平均为-2.3 ±0.7,至AH时的身高SDS增长平均为0.3±0.7SDS,修正的AH为-1.2±0.6SDS,所有这些指标均显著低于GH治疗组(平均差值分别为1.3 ,95% CI:0.9, 1.8)、1.7,95% CI:1.3, 2.3和0.9,95% CI:0.4, 1.4,均为P < 0.001)。
讨论
我们的研究证明,对SGA出生的矮身高儿童,连续GH治疗导致了儿童期身高的正常化和大部分儿童AH的正常化。在平均7.8年后,以3 IU GH/m2/d (组A)治疗的儿童的平均AH达到-1.1±0.7SDS,而以6 IU GH/m2/d (组 B)治疗的儿童的平均AH达到-0.9±0.8,GH治疗使85%的儿童的AH达到正常范围(-2.0 SDS以上),98%的儿童的AH在TH范围之内。有趣的是,两治疗组之间的AH SDS无显著性差异,由开始治疗至AH期间的平均身高SDS的增长也无显著性差异(组A:1.8±0.7SDS,男增长 12 cm、女增长11 cm;组B:2.1±0.8SDS,男增长14 cm,女增长13)。
因组A的TH SDS显著低于组B,所以当我们以TH SDS修正AH SDS时,组A(-0.2±0.8)和组B(-0.4±0.9)的平均修正的AH SDS相似。这就说明,当以遗传潜力(TH)修正AH SDS时,以3 IU/m2/d的较低GH剂量治疗的儿童得到了相同的结果。我们的研究表明98%的SGA矮身高儿童在长期GH治疗后达到的AH在TH范围之内。
有两项随机化的研究报告了GHD的SGA出生的矮身高儿童。他们发现,由开始治疗至AH期间的身高SDS增长平均为0.5和0.9 SDS,这些数值比本研究低许多,但有数种因素可解释上述研究结果的差异。他们研究中的受试者开始时的年龄较大,而且治疗时间短的多(两项研究均为4.6年)。此外,Coutant et al.的研究中GH剂量范围宽大,低剂量组平均为1.8 IU/m2/d(几乎仅为我们最低剂量的一半)。
因为医学伦理委员会未批准包括AH前的GH实验随机化对照组,所以我们将GH治疗组与相同包括标准和年龄的纵向跟踪对照组进行了比较,这一组病人因其医生未参加GH实验研究而未接受GH治疗。对照组达到的AH SDS为-2.3±0.7,在平均追踪7.5年中达到AH前的身高SDS增长为0.3±0.7,修正的AH SDS为-1.2±0.6。这些数据表明,与未治疗的SGA矮身高儿童相比,GH治疗显著增高了AH SDS。但对照组中女孩比例大于GH治疗组,因为我们研究中以SDS表示AH,不同性别之间无差异,所以不同的比例不可能影响本研究结果。
我们的研究证明,在GH治疗一年后大部分儿童达到了正常的身高,并保持在正常范围之内而达到AH,由此说明在儿童期和青春期有正常的身高。与GH治疗5年后的身高SDS相比,在治疗结束时的身高SDS稍微下降,可能是由于青春期开始较早,青春期持续时间较短,和/或骨成熟加速,而在相对较小年龄上达到AH。但是,我们在两剂量组发现,青春期开始的平均年龄与正常荷兰儿童相似(健康儿童中位数年龄为男11.5岁和女10.7岁),而青春期开始至AH期间身高平均增长为男29.8cm,女18.9cm,同时也未发现治疗停止前的青春期中骨成熟的加速。但以前发表的研究报告曾证明,未治疗的SGA儿童青春期生长突增早于正常儿童,我们发现GH治疗5年后的CA-BA差值为-1.0,说明骨龄提前1岁,这就解释了身高SDS的轻微下降。因为我们两剂量组间无显著性差异,所以骨龄提前1岁不可能与GH治疗有关。可能解释身高SDS轻微下降的另一个因素是,某些儿童在接近AH时停止GH治疗而未达到完全的身高潜力。
当以GH剂量修正后, TH SDS和开始GH治疗时身高SDS最高的儿童,其AH SDS也较高。虽然开始治疗时年龄与开始治疗至AH期间的身高SDS增长弱相关,但却与AH SDS无相关。其它的研究未发现相关的原因可能是由于他们开始治疗时的年龄较大,至AH前的治疗持续时间较短。在长期过程中影响AH的其它因素(例如,遗传背景)可能更为重要。但在我们看来,不应推迟到青春期才开始治疗,这样不仅治疗期过短,而且也将失去儿童和青春期身高正常的优势。
我们研究中的GHD儿童不是严重的GHD,而仅是不完全的GHD。这些儿童的生长和AH与无GHD的儿童相似。在全组受试者中,开始治疗前的自然与刺激的GH与AH SDS或身高SDS增长之间无相关。我们的结果与其它关于GH治疗反应与开始治疗前的GH状态无关的研究相一致。这说明,GH治疗对SGA出生的矮身高儿童是有效的,不管治疗前GH状态如何都使大部分儿童达到正常的成年身高。
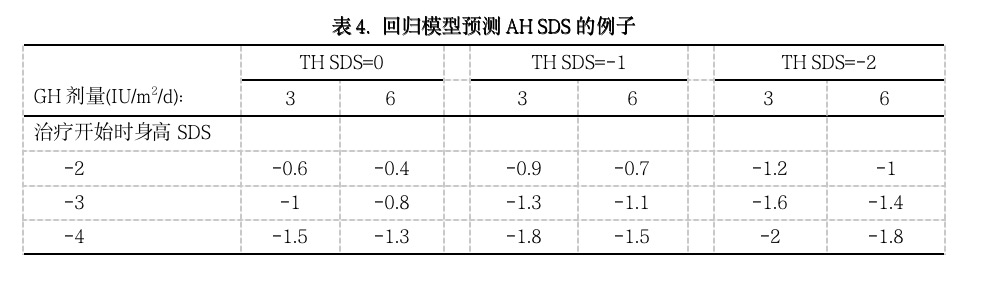
对GH剂量的建议依赖于SGA矮身高儿童的最终目的。最重要的目的可能是正常成年身高,即AH在-2 SDS以上。其次,可能是使AH在TH SDS范围之内。为了形象化每一目的对GH剂量决策的影响,我们组建了预测模型(表3)。AH SDS的预测模型表明了几种影响AH SDS的变量:TH SDS、开始治疗时的身高SDS、开始治疗时的CA-BA。包括有这些变量并不奇怪,因为发现这些变量也是预测其它病人组身高SDS和AH的因素,说明了对SGA矮身高儿童,这些因素在对GH治疗的反应中发生作用。假设一名SGA儿童在持续-2 SDS的矮身高和无骨龄延迟时(CA-BA=0,表4)时开始GH治疗,那么我们的模型可预测,在这名儿童有平均TH SDS(TH SDS=0)时,使用3 IU GH/m2/d剂量后可达到的AH为-0.6 SDS(95%预测区间(PI)在-1.8和0.6 SDS之间);而对于使用相同GH剂量的TH SDS为-2 SDS的儿童,预测的AH为-1.2 SDS (95% PI在-2.4和0之间)。如果选择了第一个治疗目的(AH在-2 SDS之上),那么两名儿童可给以3 IU GH/m2/d的剂量。当决定为第二个目的时(AH接近TH SDS),对于有较高TH SDS的儿童,可以考虑6 IU GH/m2/d的剂量。但我们的模型表明,对于TH SDS为0的儿童给以更高的剂量,预测的AH SDS仅增加0.2 SDS(-0.4 SDS,95% PI在-1.6 和0.8之间),而治疗的成本却加倍。在开始治疗时儿童身高很矮可能是考虑较高GH剂量的另一个原因,如果使用上述相同的数据(骨龄不延迟以及TH SDS=0),那么该模型说明,开始GH治疗时身高SDS为-3的儿童,使用低剂量时达到的AH SDS为-1.0(95% PI在-2.2和0.2之间),使用高剂量时达到-0.8 SDS (95% PI 在-2.0和0.4之间)。如前所述,AH的差异同样较小而治疗成本加倍。显然,不能忘记该模型仅预测了AH差异的42%,其余58%的变异由其它因素所解释,例如遗传背景。因此,尚需具有更详细表型和遗传数据的以GH治疗的SGA矮身高儿童大样本来得出更有预测价值的模型。
结论,对SGA 出生的矮身高儿童长期、连续GH治疗导致了儿童期和青春期身高的正常化。85%的病人能够达到正常的AH,而98%的病人的AH达到TH范围之内。根据我们的研究,我们建议对无赶上生长的SGA出生矮身高,以及因此而有成年身高显著降低风险的儿童,应考虑GH治疗。对于大部分儿童,3 IU/m2/d与更高的6IU/m2/d的剂量一样有效。只有极端矮身高和/或TH低于正常范围的儿童,可能需要更高的GH剂量来正常化儿童期和青春期身高。进一步的研究目标为,依据先进预测模型的治疗最佳化,使每一名儿童都有最好的治疗选择。
【金骨龄】专业骨龄及生长发育研究机构,中国骨龄行业标准制定者张绍岩教授任首席科学家,致力于提供适合中国当代少年儿童的骨龄评价技术和生长发育评价服务,独立研发了适用于医疗、体育、司法及母婴行业的骨龄软件 !
【热门问题推荐】

