摘要
人GnRH受体(GnRHR)自然突变研究可能为分析GnRH作用的信号转导通路提供有价值的方法。我们分析了两种普遍GnRHR的突变-Gln106Arg和Arg262Gln的氨基酸替代,对GnRH所产生的促性腺激素亚单位和GnRHR基因表达反应的影响。尽管有类似的GnRH刺激的肌醇磷酸生成损害,但剂量-反应分析表明Gln106Arg 和 Arg262Gln所降低的FSHß基因启动子的敏感性的程度大于LHß或GSU,提示了多条信号通道受累。此外,虽然LHß 和 FSHß基因启动子对GnRH敏感性受到两种突变的影响类似,但Arg262Gln使GSU敏感性的下降程度比Gln106Arg更大。同样,仅Arg262Gln就使GnRHR启动子敏感性显著下降。为进一步描述这些GnRHRs突变的不同下游影响的特征,我们研究了它们对其他信号转导通路的影响。突变的受体不同程度地影响了GnRH调节的ERK通路的激活和GnRH刺激的调节转录的cAMP反应成分。这些结果说明仅肌醇磷酸测量并不适合于评价突变的GnRH功能,其它的信号转导通道可能更好地反映生理学效应。LHß, FSHß,和 GSU基因表达的不同刺激可能贡献于含有这些突变病人的不同表型。
J Clin Endocrinol Metab, 2003, 88(2):834-843.
缩写词:
Bmax, Maximum binding 最大结合率;
CRE, cAMP response element cAMP应答组分;
HA, hemagglutinin 血细胞凝集素;
hGnRHR, human GnRH receptor 人GnRH受体;
HRP, horseradish peroxidase辣根过氧化酶;
IHH, idiopathic hypogonadotropic hypogonadism 特发性促性腺激素不足性腺功能减退;
IP, inositol phosphate 肌醇磷酸;
Kd, dissociation constant 离解常数;
Luc, luciferase 荧光素酶;
PKA, protein kinase A 蛋白激酶A;
PLC, phospholipase C 磷脂酶C;
RSV, Rous sarcoma virus 劳氏肉瘤病毒;
TBS, Tris-buffered saline三羟甲基氨基甲烷缓冲盐水.
前言
人GnRH受体(hGnRHR)是促性腺细胞表面存在的7个跨膜G蛋白相耦联的受体。在与hGnRHR结合时,下丘脑的十肽GnRH刺激垂体前叶的基因表达,合成和释放促性腺激素-LH和FSH。,配体对hGnRHR的刺激通过磷脂酶C(PLC)的增加,引起信号发放,导致细胞内外钙源的动员,激活PKC和MAPK通路。蛋白激酶A(PKA)/cAMP通路可能也被GnRH激活。虽然通常使用GnRH经PLC激活引起肌醇磷酸生成来评价对GnRH的信号转导反应,但不清楚这个通道的激活与促性腺激素亚单位的刺激和GnRHR基因的表达是否有关。控制基因转录的GnRH刺激确切机制也尚未确定。
因为GnRH在调节生殖功能中的重要作用,所以在特发性促性腺激素不足性腺机能减退病人筛查hGnRHR的突变。结果,鉴别出了许多与生殖功能异常相关的自然出现的hGnRHR基因突变。在体外,这些hGnRHR突变的功能分析表明,改变了细胞表达水平、配体结合,和/或信号转导。在部分IHH病人最早鉴别出了两种普遍自然出现的hGnRHR突变,它们分别为,第一次细胞外环中在106位置上(Gln106Arg)谷氨酰胺被精氨酸取代和第三次细胞内环中在262位置(Arg262Gln)上精氨酸被谷氨酰胺取代。这两种hGnRHRs突变的功能分析显示,Gln106Arg突变显著减少了GnRH的结合,而Arg262Gln对体内受体亲和力影响很小。有趣的是,两种突变引起类似的PLC激活,表现为对GnRH的细胞内IP生成减少反应。后来,在几名不同表型的IHH病人发现,Gln106Arg和Arg262Gln突变以混合杂合性同时出现或结合其它hGnRHR突变存在。最近,在一名男性无睾综合症病人和一名女性部分IHH病人发现了纯合Gln106Arg突变。
要更好地了解存在Gln106Arg和/或Arg262Gln突变病人的表型和基因型之间的关系,重要的是确定突变受体与GnRH结合下游的功能和IP产物。特别是突变受体对GnRH所产生的促性腺激素亚单位和GnRHR基因表达反应的影响有重要的病理学意义。此外,部分失活的hGnRHR突变-Gln106Arg和Arg262Gln,是研究GnRH调节促性腺激素亚单位和GnRHR基因表达中的信号转导通路的有用工具。
本研究在体外分析了Gln106Arg 和 Arg262Gln对GnRH刺激的促性腺激素亚单位和GnRHR基因启动子激活的影响。尽管这两种突变受体引起类似的对GnRH的IP反应减小,但对GnRH刺激的促性腺激素亚单位和GnRHR基因表达有不同的影响。因此,也研究了突变受体对其它信号转导通路的影响,以确定两种突变导致不同效应的机制。
材料与方法
细胞培养
所有培养试剂由Life Technologies Inc获得。在低葡萄糖DMEM中培养COS-7和GH3细胞。在37℃下5% CO2的潮湿空气中,孵化细胞。
定点诱变
使用定点诱变,将Gln106Arg 或 Arg262Gln引入Dr. Thomas Gudermann所提供的编码野生型hGnRHR表达载体。在Gln106Arg hGnRHR突变中,使用引物对:sense, 5'-GTGGACATTACAGTCCGATGGTATGCTGGAGAG-3',和 antisense, 5'-CTCTCCAGCATACCATCGGACTGTAATGTTCCA C-3',在hGnRHR核苷酸372位置上,Gln 密码子 CAA 被Arg 密码子 CGA所替代。在Arg262Gln hGnRHR突变中,使用引物对: sense, 5'-CAATATACCAAGAGCACAGCTGAAGACTCTAAAAATGACG-3',和antisense, 5'-CGTCATTTTTAGAGTCTTCAGCTGTGCTCTTGGTATATTG-3',在hGnRHR 840位置上Arg密码子 CGG 被 Gln 密码子 CAG替代。使用QuikChange 定点诱变药盒产生hGnRHR突变,所插入的突变由双向测序证实。
免疫细胞化学
COS-7细胞涂于35mm的玻璃培养皿中,使用GenePorter转染试剂(野生型, Gln106Arg,或Arg262Gln),或对照表达载体(pcDNA3),进行瞬时脂质体转染。在37℃下孵育48小时后,以冰冻PBS洗涤细胞,在室温下以新鲜的4%甲醛溶液固定30分钟,以PBS洗涤两次,在室温下以PBS/1%BSA闭锁30分钟。在37℃下以5ug/ml抗(HA)荧光剂抗体整夜孵化细胞,并以PBS洗涤4次。使用共焦激光显微镜在x40油浸接物镜下检测细胞完整表面上的野生型和突变型hGnRHRs。
受体结合测定
COS-7细胞涂于60mm组织培养皿中,每hGnRHR结构或pcDNA3井3ug经脂质转染法瞬时转染。在37℃下孵育48小时后,以DMEM和0.1% BSA洗涤细胞,在室温下,使用Dr. P. Michael Conn所提供的100000cpm 125I-布舍瑞林孵育90分钟,增加非标记GnRH浓度 (10-12至10-6 M) 。以冰冻PBS洗涤两次,以0.2 M NaOH, 0.1% SDS溶解。计算溶解的细胞蛋白含量,使用γ计数器测量放射性。根据同源竞争结合分析方法的非线性回归计算离解常数(Kd)和最大结合率(Bmax)。每一实验至少重复三次。
IP测定
以前已经报告了测量总IP产物所应用的方案。在6井培养板上,通过每hGnRHR 结构或pcDNA3井2ug电穿孔瞬时转染 COS-7细胞。在37℃下24小时孵育后,以1ml去纤维醇的DMEM置换培养基2小时,然后以含有2 µCi myo-(2-3H)纤维醇相同的1ml培养基替换,15分钟后加10 mM LiCl。在37℃下孵育16小时后,以逐渐增加浓度(10-11至10-6 M)的GnRH刺激细胞45分钟,进行时间过程研究,GnRH诱导的IP积聚在45分钟时最大。在冰中以20 mM的甲酸萃取细胞两次,以7.5 mM HEPES and 150 mM KOH将溶解物中和到pH7.5。以14,000 x g离心2分钟后,测量溶解物中的蛋白,取上清液至Ag-X8阴离子树脂交换柱。以5ml ddH20,然后以5ml的5mM浓度的硼砂, 60 mM甲酸钠洗涤。以3 ml的0.9 M 甲酸铵, 0.1M 甲酸萃取IPs。使用闪烁记数器测量洗脱液中的放射活性结合,每一样本以蛋白量修正,所有测量进行三次。每一实验至少重复三次。
荧光素酶的测定
通过大鼠LHß基因-797/+5、FSHß基因-2000/+698,人GSU基因-846/0,和小鼠GnRHR基因-1164/+62与荧光素酶(Puc)cDNA融合产生指示结构。cAMP反应成分(CRE)指示结构含有4个荧光素酶上游CREs。以每井2ug的hGnRHR结构或pcDNA3,每井2ug的GSU-Luc、FSHß-Luc、LHß-Luc或GnRHR-Luc、或1ug 的CRE-Luc,每井1ug鲁斯肉瘤病毒β-半乳糖苷酶载体,电穿孔瞬时转染GH3细胞。然后将细胞种入6井组织培养板中,在37℃下孵化48小时,以逐渐增加浓度(10-11 至10-5 M)的GnRH刺激4小时(根据时间过程研究,在这个时间点上得到最大的GnRH刺激的Luc活性)。以冰冻PBS洗涤细胞两次。以125 mM 的三羟甲基氨基甲烷盐酸盐和0.5% 氚核溶解细胞。在4℃下14,000 x g离心后,测量上清液Luc和ß-半乳糖苷酶活性,结果以非刺激样本的倍数表示。所有点进行三次测定,每一试验至少重复3次。
ERK-1磷酸化的蛋白质印迹分析
以每井2ug的hGnRHR结构或pcDNA3,以及每井2ug的HA示踪野生型ERK-1表达载体瞬时转染GH3细胞。在37℃下孵育24小时后,在0.1% BSA稳定的无血清培养基(DMEM)中孵化细胞24小时,然后以逐渐增加浓度(10-10至10-5 M)的GnRH刺激10分钟。时间过程研究表明,GnRH引起的ERK-1磷酸化在10分钟时达到最大。然后在冰上以含有0.1% mg/ml的苯甲基磺酰氟、30 mg/ml抑肽酶和1 mM的钒酸钠的 RIPA 缓冲剂(1 x PBS, 1% 非离子型表面活性剂 CA-630, 0.5% 脱氧胆酸钠, 0.1% SDS)溶解细胞,并超声粉碎20秒。在4℃下14,000 x g离心后,测量上清液中的蛋白含量,每井40ug变性蛋白加入到12%的聚丙烯酰胺凝胶中,按照标准程序进行电泳分析。将蛋白转移到聚偏二氟乙烯膜上,在4℃下以Blotto整夜阻断。在37℃下的Blotto中以抗p-ERK抗体孵化膜2小时,以TBS,0.05% Tween-20洗涤3x10分钟,以TBS洗涤1x10分钟。然后在37℃下再以与辣根过氧化物酶(HRP)共轭的单克隆第二抗体在Blotto中孵化1小时,在进行适当的洗涤。在化学发光法检测后,将膜在胶片上曝光。在带洗涤后,在Blotto中以抗-(HA)-HRP抗体再次复制1小时,修正转染率和蛋白装载。修正的结果以扫描非刺激样本胶片的密度分析的倍数表示。每一实验至少重复三次。
计算和统计分析
每组实验数据进行非线性回归分析,计算每研究的ED50。所有统计分析使用Instat3.0,并根据非参数的非配对t检验(P <0.05)
结果
突变的hGnRHRs细胞表面的表达
为保证突变hGnRHRs的表达,以hGnRHR结构瞬时转染COS-7细胞,并以免疫细胞化学方法分析固定的完整细胞表面野生型和突变受体的表达。使用野生型hGnRHR表达载体作为阳性对照,使用pcDNA3作为阴性对照。所有hGnRHR 表达载体氨基端都有HA表位标签,以有利于无有效抗GnRHR抗体的受体测定。在以荧光素共轭的抗-HA-抗体孵化转染细胞后,获得了共焦荧光显微镜图像(图1)。在以野生型hGnRHR 以及Gln106Arg、Arg262Gln突变转染细胞的外围检测到了荧光,但在以pcDNA3转染的细胞表面未发现荧光。所有hGnRHRs的萤光形式类似,提示了正常的细胞表达和向膜的转运。虽然不能完全排除氨基端HA标签的存在可能影响细胞表面的表达或与配体的结合,但未观察到对野生型hGnRHRs的影响。

图1. 细胞表面野生型、Gln106Arg和Arg262Gln hGnRHRs的存在。
受体结合的特征
为测量GnRH结合,以每种hGnRHR结构或pcDNA3转染COS-7细胞。为进行置换层析分析,以100,000 cpm 125I-布舍瑞林和增加浓度的非标记的GnRH孵化细胞。在同源竞争结合分析的非线性回归后,计算野生型、Gln106Arg和Arg262Gln hGnRHR结构的Kd和Bmax(表1)。pcDNA3与GnRH无结合,而在野生型与Arg262Gln GnRHR之间,亲和力或受体数量无显著性差异。因为Gln106Arg的结合显著减少,所以不能准确地计算Kd和Bmax。这些结果与以前报告的突变一致。
对GnRH的反应-IP的积聚
为证实本研究使用的hGnRHR结构保持了部分细胞内信号转导通路激活功能,测量了瞬时转染的COS-7细胞对GnRH剂量渐增的IP生成反应。野生型hGnRHR能够介导10倍的IP积聚刺激,ED50为2.5 nM GnRH(图2,表1)。两种突变引起剂量-反应曲线向右偏移,类似导致ED50增长约7倍,也与以前的报告一致。作为阴性对照,pcDNA3并不刺激IP生成。使用瞬时转染的GH3细胞,这些突变也同样导致类似的调节GnRH刺激IP的结果。
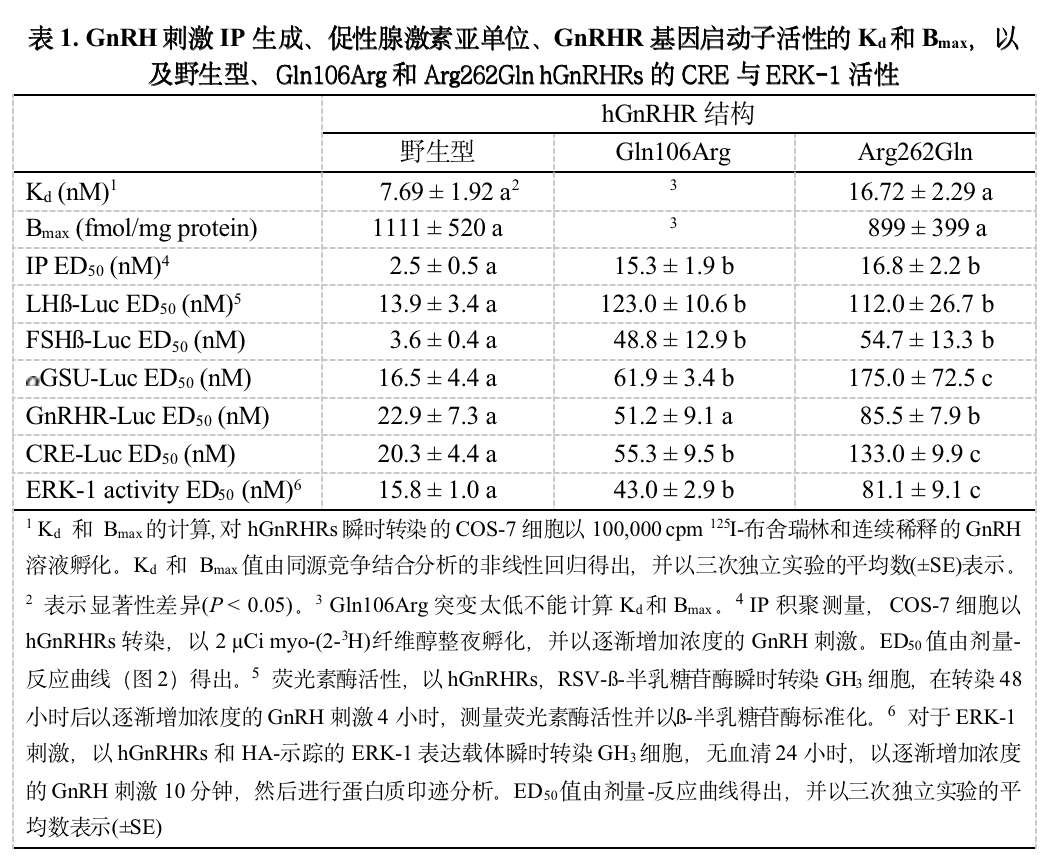
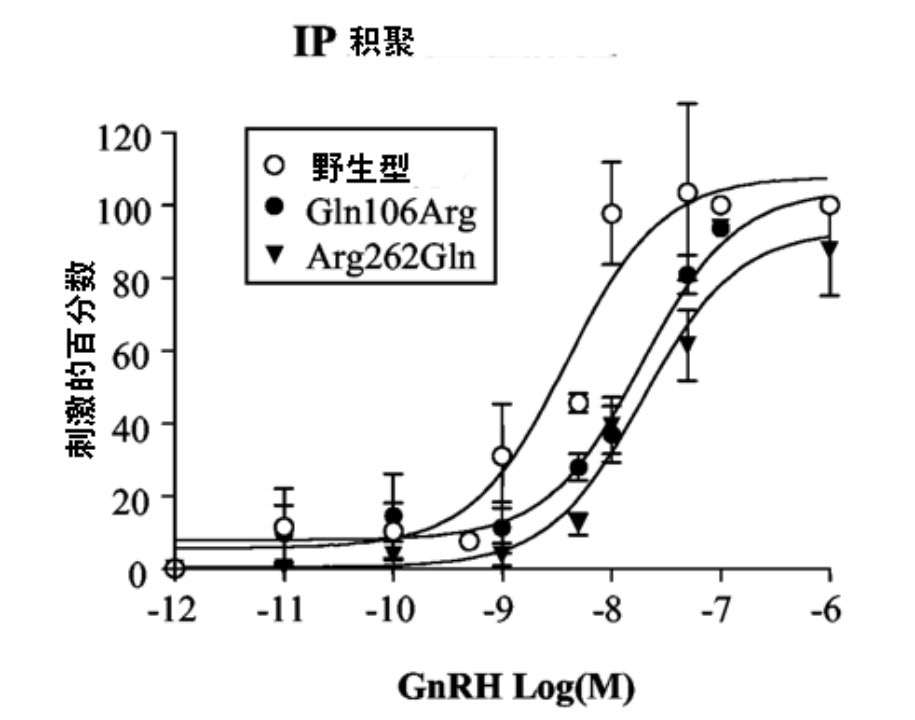
图2. 野生型、Gln106Arg, and Arg262Gln hGnRHRs调节GnRH刺激IP的生成。
不同GnRHRs突变对GnRH促性腺激素亚单位基因启动子活性的影响
GnRH刺激促性腺激素生物合成的信号转导通路尚未完全阐明。尚不了解IP生成是否与促性腺激素亚单位基因表达高度相关。因此,测量表达突变hGnRHRs 的细胞中GnRH刺激促性腺激素亚单位基因表达的能力。
以hGnRHR结构或pcDNA3瞬时转染GH3细胞,Luc标记与LHß、 FSHß、GSU启动子以及RSV-ß-半乳糖苷酶融合。当使用COS-7细胞做这些实验时,甚至在野生型,都未观察到促性腺激素亚单位或GnRHR基因启动子活性受到GnRH的刺激。与此相反,前面说明的GH3细胞支持了促性腺激素激素亚单位和GnRHR基因启动子对GnRH的反应性。如上所述,在GH3和COS-7细胞,hGnRHRs突变对GnRH调节的IP生成有类似的影响,因此而验证了两种模型的比较。
图3为以LHß-Luc、FSHß-Luc、GSU-Luc转染的GH3细胞的剂量-反应分析。在表1中汇总了每种促性腺激素亚单位和受体结构的ED50。对LHß-Luc,Gln106Arg 和Arg262Gln两种突变引起ED50分别增加8.8和8.1倍(即对GnRH的敏感性下降,图3A,表1)。因此,两种突变受体降低GnRH刺激的LHß基因启动子活性的程度相同,其方式也与对GnRH刺激的IP生成的影响相似。
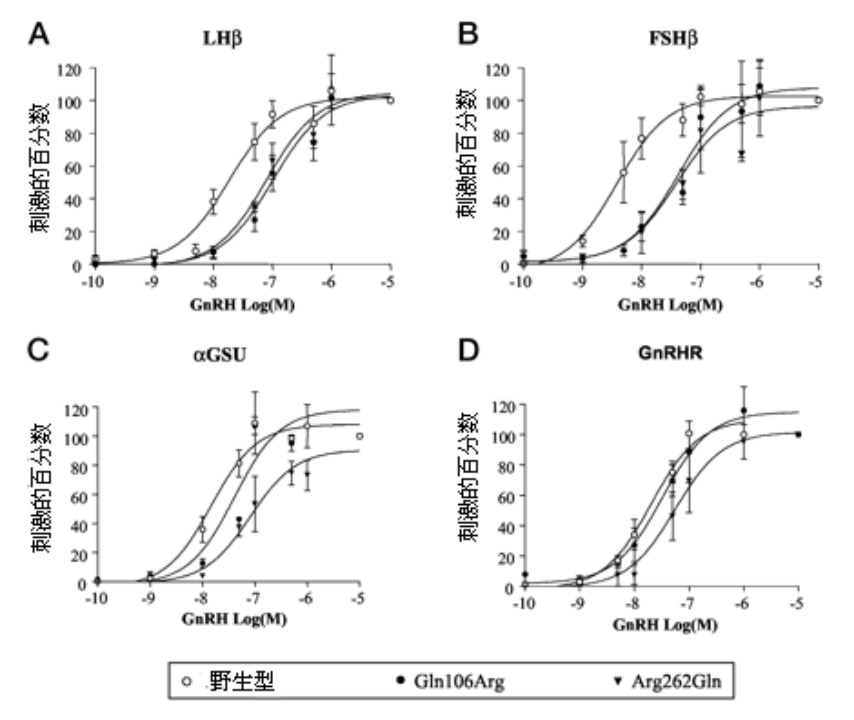
图3. 野生型、Gln106Arg、Arg262Gln hGnRHRs
对促性腺激素亚单位和GnRHR基因启动子的不同刺激。
受体结构(A)LHß-Luc, (B) FSHß-Luc, (C) GSU-Luc, 和(D) GnRHR-Luc;
结果以每一hGnRHR最大刺激的百分数表示。
两种突变受体降低了FSHß亚单位基因启动子对GnRH的敏感性,与野生型比较,Gln106Arg和 Arg262Gln分别降低了14和15倍(图3Bhe biao 1)。虽然两种突变降低对GnRH的敏感性程度相同,但这些影响大于对GnRH刺激的IP生成和LHß基因启动子刺激的影响。有趣的是,在这些研究中,相对于野生型受体来说,FSHß亚单位基因启动子对于GnRH的敏感性约比LHß或GSU基因启动子大5倍。
就GSU基因启动子来说,Gln106Arg对GnRH敏感性下降相对于野生型受体下降3.8倍,Arg262Gln下降了10.6倍(图 3C,表1)。有趣的是,Arg262Gln突变对于GnRH介导GSU-Luc刺激的剂量-反应曲线的影响大于Gln106Arg突变。两种突变对GSU的影响,不同于对GnRH刺激IP生成和LHß、FSHß基因启动子活性的影响。
GnRH对GnRHR基因启动子活性的刺激
因为GnRH调节本身受体的表达,所以由于hGnRHR突变而出现的hGnRHR基因启动子刺激的差异可能导致在体细胞表面受体数量的变化。因此,进行实验来研究两种hGnRHR突变是否影响对GnRH刺激的GnRHR基因表达。以hGnRHR结构或 pcDNA3瞬时转染GH3细胞,荧光素酶示踪剂融合到小鼠GnRHR基因启动子(GnRHR-Luc)和RSV-ß-半乳糖苷酶载体。图3D为得到的剂量-反应曲线,ED50列于表1。GnRHR基因启动子对GnRH的敏感性中等程度下降,Gln106Arg下降2.2倍(即ED50增加),Arg262Gln下降3.7倍。如对GSU的不同影响一样,两种突变的hGnRHRs对于GnRH刺激GnRHR基因启动子活性的剂量-反应曲线有不同的影响。
GnRH刺激的ERK激活
Gln106Arg和Arg262Gln对促性腺激素亚单位和GnRHR基因启动子激活的影响提示,这两种不同的受体突变可能对GnRH激活基因表达的信号转导通路有不同的影响。两种突变受体对GnRH刺激IP生成的影响相同仅部分解释了这些明显不同的影响,提示了可能存在另外的信号转导通路。已经证明GnRH刺激FRK活性,这个MAPK通路在GSU基因启动子转录激活中发挥作用,并增加LHß蛋白。因此,我们测定了Gln106Arg和Arg262Gln对GnRH刺激ERK通路的影响。
因为在我们的瞬时转染范例中,内源性磷酸化ERK水平掩盖了GnRH介导ERK激活的影响,所以,用每种hGnRHR结构或pcDNA3,以及HA示踪的野生型ERK-1表达载体瞬时转染GH3细胞。并以渐增GnRH浓度刺激细胞,然后进行蛋白质印印迹分析。在图4A中表示了野生型和突变受体GnRH对ERK-1的剂量依赖性激活,以及pcDNA3阴性对照的无GnRH刺激的ERK活性。使用谱带强度的密度分析,确定相对于总HA-ERK-1的磷酸化HA-ERK-1,并用来修正转染率和蛋白装载。使用这些数据生成剂量-反应曲线(图4B),计算每种受体结构ERK-1激活的ED50(表1)。对于Gln106Arg,ED50是野生型的2.7倍,而Arg262Gln的ED50增加到5.1倍。因此,Gln106Arg和Arg262Gln对GnRH刺激ERK活性的ED50有不同的影响,与这些突变对GSU和GnRHR基因启动子活性的影响方式相似。
图4. 野生型、Gln106Arg、Arg262Gln hGnRHRs对ERK-1磷酸化的影响。
GnRH刺激的CRE-Luc激活
已经提出,GnRH刺激的cAMP依赖性通路可能具有调节促性腺激素亚单位基因表达和LHß水平的作用。通常使用刺激的CRE-Luc作为cAMP诱导的标志。为了测量CRE介导的转录,以hGnRHR结构或pcDNA3、 CRE-Luc示踪结构和RSV-ß-半乳糖苷酶载体瞬时转染GH3细胞,以渐增浓度的GnRH刺激细胞,产生剂量-反应曲线(图5)。Gln106Arg突变的GnRH刺激活性的ED50比野生型高2.7倍,而Arg262Gln突变则高6.7倍(表1)。因此,Gln106Arg和Arg262Gln突变对GnRH刺激依赖CRE的转录有不同的影响,与GnRH介导GSU、GnRHR基因启动子刺激和ERK激活所观察到的方式一致。

图5.野生型、Gln106Arg, and Arg262Gln hGnRHRs对CRE-Luc的激活
讨论
在本研究中,我们分析了hGnRHR的Gln106Arg and Arg262Gln突变对GnRH刺激促性腺激素亚单位和GnRHR基因表达的影响。此外,也研究了对信号转导通路的影响,以确定两种突变可能改变GnRH刺激促性腺激素亚单位和GnRHR基因启动子活性的机制。
由于较高的转染率,我们在COS-7细胞完成了结合测定和IP的分析。这种细胞系也常用于计算全细胞或膜片段的Kd和测量IP水平,描述hGnRHRs突变的特征。由于COS-7细胞对GnRH无反应,所以后来使用GH3细胞进行实验,测量促性腺激素亚单位基因启动子活性。因此,我们使用GH3细胞重复了IP分析,虽然在GnRH刺激后IP积聚增长的幅度不如COS-7细胞,但两细胞系野生型和突变受体之间的ED50差异是相同的,验证了这些比较。
有趣的是,尽管GnRH介导IP生成的敏感性类似下降,但Gln106Arg和 Arg262Gln hGnRHR突变却导致了促性腺激素亚单位基因对GnRH的显著不同的敏感性。在检测突变受体之前,我们首先观察到,对于野生型hGnRHR,FSHß亚单位基因启动子对GnRH刺激的敏感性高于LHß或GSU基因启动子。这个结果与以前关于引起FSH分泌需要的GnRH量少于LH的在体观察相一致。此外,曾有报告,在肾包膜下移植腺垂体并给以GnRH处理的垂体切除大鼠,在LH之前FSH血浆浓度增加。野生型FSHß基因启动子对GnRH的敏感性较高提示,FSHß基因对于细胞内通路激活的敏感性大于LHß和GSU基因,或是存在不同的信号通路。
突变受体剂量-反应曲线的分析显示,Gln106Arg和Arg262Gln使FSHß亚单位基因启动子对GnRH的敏感性减少的程度大于LHß或GSU。这可能是由于促性腺激素亚单位基因对共同的信号转导通路的剂量依赖性激活的下降有不同的敏感性。但是,FSHß基因对低剂量的GnRH有较高的敏感性,所以可以预期该基因转录的激活受到共同信号转导通路的损害的影响较小,而非更受影响。这将支持促性腺激素亚单位基因对GnRH的不同反应可能存在一条以上的信号转导通路。
Gln106Arg和Arg262Gln对GnRH刺激的GSU基因启动子活性有显著不同的影响。两种突变都降低了GSU基因对GnRH的敏感性,但是Arg262Gln hGnRHR突变的ED50的变化更明显。尽管二者对GnRH调节的IP生成影响相同,但对GSU基因活性的影响不同。与此相反,两种突变对LHß和FSHß亚单位基因对GnRH敏感性的影响相似。所以,GSU基因似乎与不同于LHß或FSHß基因激活的信号转导通路有关,而可能取决于不同的机制。显然,仅测量IP产物不适用于确定生理活动中的突变受体功能。在本文突变受体引发的不同下游影响中,非常可能存在经PLC以外的重要信号转导通路,应更详细地加以研究。
与对GSU基因活性的影响类似,Gln106Arg和Arg262Gln hGnRHR突变也引起GnRHR基因启动子对GnRH敏感性的不同下降,其中仅Arg262Gln突变达到统计学显著性。垂体促性腺激素细胞对GnRH的反应与细胞表面的GnRHRs浓度直接相关,GnRHRs浓度部分受到GnRHR基因表达水平的影响。因为GnRH本身调节自己受体的表达,所以可以预期,GnRH刺激GnRHR基因启动子激活的障碍,将不能引起GnRH脉冲引起的受体上调,贡献于促性腺激素细胞表面GnRHRs数量的下降。反过来,进一步增加GnRH在体的抵抗。
在本研究中,我们未分析突变对细胞表面表达的可能影响。除了对剂量-反应曲线和ED50值的影响外,Gln106Arg 和 Arg262Gln突变可能也影响这些受体的合成/降解速率,导致GnRHR水平的变化。这些考虑与最近报告的看法非常一致,这些研究报告某些突变GnRH受体表达水平降低,这些突变的结构改性或是使用能透过膜的非肽类hGnRH拮抗剂可部分恢复配体的结合,刺激IP的生成。在我们的配体结合测定中,Bmax指标证实转染细胞表达了相同量的野生型和Arg262Glu hGnRHRs。虽然因所检测的结合受体水平很低,我们未能够定量Glu106Arg的Bmax,但共焦显微镜分析指出,野生型和Glu106Arg受体细胞表面的萤光表现相似。尽管如此,我们目前的研究集中在Gln106Arg 和 Arg262Gln对GnRH激活单一信号转导通路和基因转录的ED50值的影响。虽然受体数量的变化可能影响特定GnRH浓度下的绝对反应和最大反应,但可以预期ED50值保持不变。已经证明,ED50与受体数量无关,而是反应了受体对配体亲和力以及受体与效应物耦合(例如,G蛋白)的变化。特别是,曾经证明GnRH激动剂刺激GH3细胞IP生成的潜力与GnRHR浓度无关。我们进行的野生型、Glu106Arg、Arg262Glu GnRHRs的GnRHR分析也说明,突变受体对GSU基因启动子对GnRH的敏感性的不同影响与受体浓度无关(未报告数据)。然而,ln106Arg 和 Arg262Gln突变对受体数量或循环的影响是进一步研究的方向。
虽然野生型hGnRHR存在HA标记对细胞表面的表达或功能无影响,但我们并不能完全排除HA标记对突变受体功能的影响。在这方面,值得注意的是,我们研究中Gln106Arg和Arg262Gln对配体结合和IP产物的影响与以前的研究(使用无HA标记的受体)相一致。而且,如上所述,HA标记对突变受体细胞表面表达的可能影响并不影响ED50值。
为了确定Gln106Arg和Arg262Gln突变是否影响经IP产物之外的其它信号转导通路-GnRH刺激促性腺激素亚单位和GnRHR基因表达,我们研究了GnRH对ERK磷酸化和依赖CRE转录的刺激。已经提出,ERK/MAPK通路在GnHR介导的GSU、可能的LHß基因、FSHß基因的转录激活和LHß蛋白的表达中发挥作用。在原代垂体细胞培养和T3–1、LßT2促性腺激素细胞系中,GnRH激活ERK级联。基础的和GnRH刺激的GSU基因活性似乎通过ERK通路来调节。ERK或其它MAPKs也似乎在GnRH调节LHß基因表达中发挥作用。我们的结果证实,Gln106Arg和Arg262Gln突变hGnRHRs对GnRH激活ERK通路有不同影响。两种突变hGnRHRs降低了GnRH引起的ERK激活的敏感性,但Arg262Gln hGnRHR突变引起的ED50变化更大于Gln106Arg,与GSU和GnRHR基因启动子对GnRH的激活反应中所观察到ED50变化方式相同。有趣的是,虽然GnRH调节的ERK激活出现在蛋白激酶C的下游,尽管本文所研究的两种突变对GnRH调节的IP生成有相同的影响,但对GnRH引起ERK激活的影响不同。其它的信号转导通路,钙离子流和上皮生长因子受体]酪氨酸激酶,也可能作用于GnRH调节的ERK激活,并贡献于Gln106Arg和Arg262Gln对ERK通路的不同影响。
几项报告提出,GnRH刺激的依赖cAMP通路可能也作用于GnRH调节的促性腺激素亚单位基因。已经证明cAMP增加原代大鼠垂体细胞培养中的LHß和GSU mRNA水平,细胞内cAMP水平下降引起GnRH刺激的促性腺激素亚单位mRNA水平和促性腺激素分泌减少,提示PKA通路可能贡献于GnRH刺激的促性腺激素亚单位基因的表达。另外,已经证明GnRHR与LßT2 细胞内Gs及Gq结合,GnRH刺激导致cAMP水平的增加。Gs通路的特异阻断引起ERK活性下降和c-fos及 LHß蛋白的减少。我们在分析hGnRHR突变中,使用了GnRH刺激CRE-Luc作为诱导cAMP通路的标志。对于依赖CRE的转录,在GnRH刺激GSU和GnRHR基因启动子活性时观察到,Gln106Arg和Arg262Gln突变的影响表现出了类似的GnRH敏感性损失,Arg262Gln hGnRHR突变引起引起ED50的变化仍然大于Gln106Arg。因此,我们的数据提示,cAMP调节通路也是介导Gln106Arg和Arg262Gln不同影响的候选者。但是,应当注意到CRE对除cAMP/PKA以外的通路是敏感的。其中应特别注意磷酸化和CRE结合蛋白B的激活出现在MARK激活的下游。可能存在几种信号转导通路通过复杂的联系系统共同调节促性腺激素亚单位和GnRHR基因的表达。
在体外研究中使用两种自然出现的常见突变,可能有助于阐明hGnRHR结构变化是如何作用于部分失活突变病人的相当不同表型。以前已经在不同程度IHH病人鉴别出了Gln106Arg和Arg262Gln hGnRHR突变。最近,发现一名不育综合症男性病人为纯合性Gln106Arg hGnRHR突变。此外,一名纯合性Gln106Arg hGnRHR突变女性病人实现了自然怀孕。在所报告的男性病人中,两种促性腺激素基础水平均在正常范围内,对于一次注射GnHR(100ug)的反应,促性腺激素的增长不同,LH的增长大于FSH。同样,7天脉冲式GnRH处理仅引起LH反应,FSH未增长。这些在体的反应与我们体外观察到的Gln106Arg突变引起FSHß基因对GnRH的敏感性降低程度大于LHß和GSU的结果一致。如Pitteloud et al.提出的,FSH对GnRH无反应,也可能是由于这些男性病人有相对较高的循环抑制素B水平。
至今,尚未在病人观察到纯合性Arg262Gln突变。但报告了几种存在Gln106Arg 和Arg262Gln突变的混合杂合性。虽然看到了这些混合杂合性表型的可变性,但非常可能是由于性别和其它内分泌对生殖控制的影响,这些病人都表现出比相对轻微临床表现的Gln106Arg纯合性有严重的多的IHH表型。仅根据IP反应的评价可能会对表型严重性差异感到奇怪,但由两种突变的hGnRHRs对GSU的刺激表现出不同的GnRH敏感性下降可以得到解释。而且,Arg262Gln 引起的GnRH对GnRHR基因表达刺激的下降程度也大于Gln106Arg。这就可以预期,与Gln106Arg纯合性相比,混合杂合性的促性腺激素细胞表面GnRHR受体数量减少,将进一步形成对GnRH刺激促性腺激素细胞的复合抵抗。
总之,我们在体外分析了两种常见的hGnRHR自然突变-Gln106Arg和Arg262Gln,对GnRH刺激促性腺激素亚单位和GnRHR基因启动子活性的影响。尽管两种突变受体引起对GnRH的IP下降反应类似,但观察到了对GnRH刺激促性腺激素亚单位和GnRHR基因表达的不同影响,提示两种突变对共同的信号通路有不同的作用,或者说,更可能对不同的信号转导通路有显著不同的影响。进一步的研究阐明了突变受体对GnRH刺激ERK活性和CRE介导的转录的确有不同的影响。仅测量广泛用来估价hGnRHR突变信号发放能力的IP产物,显然不适合确定相关生理活动中的突变受体的功能。对GnRH刺激的LHß、FSHß、GSU亚单位基因表达的不同影响可能解释了某些hGnRHR突变引起IHH病人某些表型的变异。这些自然出现的突变是研究调节GnRH对促性腺激素亚单位和GnRHR基因表达不同影响的信号通道的有效工具。
【金骨龄】专业骨龄及生长发育研究机构,中国骨龄行业标准制定者张绍岩教授任首席科学家,致力于提供适合中国当代少年儿童的骨龄评价技术和生长发育评价服务,独立研发了适用于医疗、体育、司法及母婴行业的骨龄软件!
【热门文章推荐】
促性腺激素释放激素受体纯合子R262Q突变表现为体质性生长和青春发育期延迟
以促性腺激素释放激素类似物和氧雄龙治疗的 特发性中枢性性早熟女孩的最终身高

