摘要:
过早阴毛初现的定义为女孩8岁前和男孩9岁前出现,传统上认为是良性体。但是,最近的证据支持女孩过早阴毛初现可能是代谢综合症的预兆,并可能在青春期卵巢雄性激素过多症临床表现之前出现的观点。在过早阴毛初现之前,胎儿生长下降、然后出生后的身高,特别是体重过多赶上生长时更常见上述出现次序;高胰岛素血症似乎是出现这种事件次序的关键因素。在阴毛初现过早及有低出生体重史的女孩,青春期开始较早而且进程更快,因而可能中等程度地降低成年身高。在这些女孩,以甲福明治疗可能逆转临床卵巢雄性激素过多,正常化身体组成和过多的腹部脂肪,延迟青春期的进程而不损害线性生长和骨骼矿化,提示了成年身高可能得到改善。但尚需要对这些病人长期追踪,以完全确认胰岛素敏感化的最终影响,以及停止治疗后这些益处的保持状况。
Rev Endocr Metab Disord (2009) 10:63–76
关键词:阴毛初现过早,卵巢雄性激素过多症,甲福明,胰岛素,内脏脂肪
1、前言
肾上腺功能早现指的是肾上腺雄性激素生成过早增长,通常导致女孩8岁前和男孩9岁前阴毛发育(或阴毛初现),也可能出现腋毛发育初现和顶质分泌,但与青春期发育无关。女性由于肾上腺功能早现而过早阴毛初现的发生率几乎是男性的10倍。
传统上将过早阴毛初现看作为是一种极端的正常变异。但是越来越多的证据支持了下述的观点:女孩过早阴毛初现不再是良性的,而可能是代谢综合症的预兆,并在青春期卵巢雄性激素分泌过多症之前出现。这种发生次序更多出现在阴毛初现过早之前胎儿期生长下降而出生后的身高特别是体重过多赶上生长的情况下。
在本综述中,将讨论女孩由于肾上腺功能早现的过早阴毛初现与代谢综合症、卵巢雄性激素过多症的关联,以及预防和逆转可能出现的内分泌-代谢异常的治疗策略。
2.阴毛初现过早
2.1 病理生理学基础
Wilkins最早报告了阴毛和/或腋毛过早发育,而没有其它男性化或青春期发育征兆的现象,并将这种现象称为“过早阴毛初现” (premature pubarche)。几年后,其它研究者提出这种情况的出现可能与肾上腺有关,因而称其为“肾上腺功能早现”(premature adrenarche)。
最常见的过早阴毛初现是继发于肾上腺功能正常成熟过早的变异体,就是通常所说的,典型的或单纯性的过早阴毛初现,对于生活年龄来说,可见雄性激素、脱氢表雄酮(DHEA)、脱氢表雄酮硫酸盐(DHEAS)、雄烯二酮(Δ4-A)和睾酮(T)有中等程度的增长,但相对于Tanner阴毛发育等级来说在正常范围之内。有时,阴毛过早发育与生活年龄的正常雄性激素水平相关,提示外周对雄性激素的敏感性增加。类固醇生成酶的缺陷是过早阴毛初现的病因,所报告的人群发生率不同。
目前,尚不清楚肾上腺在典型的过早阴毛初现中的作用。一种假设的非ACTH的、垂体分泌的共有人促阿黑皮素原79-96氨基酸的激素,与ACTH一起过度刺激了肾上腺分泌雄性激素,但仍缺乏证实资料。其它的理论假设为,生成肾上腺雄性激素的网状带发育加速。最近曾提出,正常的肾上腺功能初现可能是由于通过cAMP依赖性激酶,细胞色素P450c17 (CYP17)的丝氨酸/苏氨酸的磷酸化而引起,这个过程的过早激活可能是过早刺激肾上腺雄性激素分泌的原因。最后,曾发现促肾上腺皮质激素释放激素(CRH)对正常男性和过早阴毛初现女孩肾上腺雄性激素的释放有即刻的和直接的作用,提示了该激素在肾上腺功能正常和早现中的病理生理作用。
营养状态也可能是肾上腺功能初现的调节因素。出生前后的体重增长似乎对肾上腺功能初现有相对应的作用,在正常出生体重范围内的小婴儿,在儿童期体重迅速增长,表现有最高水平的循环肾上腺雄性激素。
2.2 临床特征
在女孩,主要在大阴唇出现黑色卷曲粗糙的阴毛,因此在肥胖病人,不经意地检查不易发现。阴毛的发育由无到缓慢的进展,也可能遍布阴部。也可能出现腋毛、体臭增强、油性皮肤和通常以少许黑头粉刺形式的痤疮。在单纯性过早阴毛初现,阴蒂或阴茎不增大,睾丸和乳房保持青春期前状态。
在诊断时,过早阴毛初现儿童通常高于同伴,儿童期的生长开始较早。对于生活年龄来说生长速度和骨成熟度中等增加,但与身高年龄一致。在女孩,这些临床特征伴随以胰岛素样生长因子(IGF-I)循环水平的增长,并持续进入青春期。
2.3 肾上腺雄性激素
在大部分病例,过早阴毛初现伴随有正常肾上腺功能初现范围内的循环类固醇水平,DHEAS水平在40μg/dL以上,该数值高于6-8岁的平均水平,但在青春期初期的正常限度之内(图1)。DHEAS的增长通常伴有DHEA、T和Δ4-A水平的轻微升高。对ACTH刺激的血清皮质类固醇反应与这些变化相一致,17-羟基孕甾类固醇酮和DHEA增加。某些过早阴毛初现女孩可能表现出肾上腺功能初现增强或过度,肾上腺功能初现增强或过度是一个术语,通常应用于基线DHEAS或Δ4-A,或对ACTH刺激试验中17-羟基孕甾类固醇酮和DHEA反应高于青春期初期的女孩。过度肾上腺功能初现是肾上腺P450c17 (CYP17)类固醇生成调节紊乱的早期表现,与持久性肾上腺雄性激素过多症及其后来出现卵巢雄性激素过多的风险增加有关。
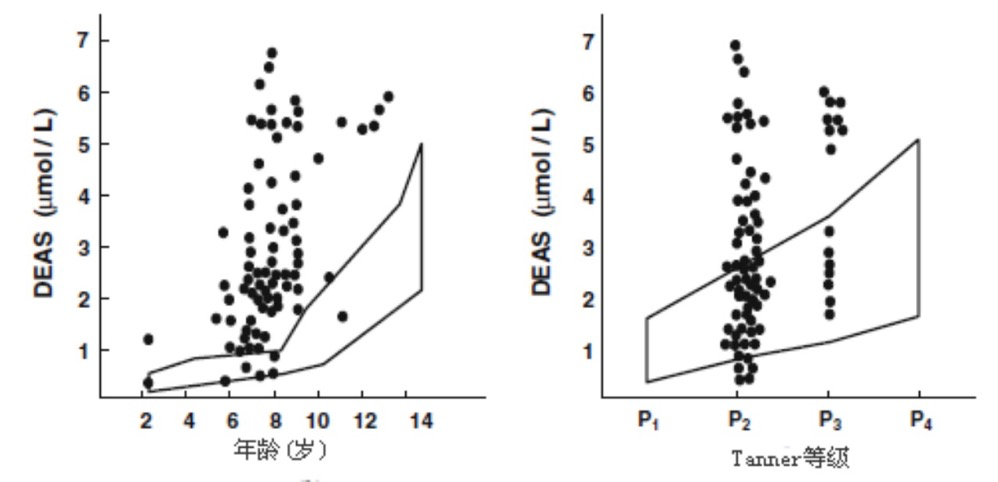
图1. 过早阴毛初现女孩血清脱氢表雄酮硫酸盐水平与相同生活年龄和Tanner等级女孩的比较.
(图中折线部分为对照组平均2SD水平)
2.4 青春期发身时间和最终身高
过早阴毛初现女孩的青春期开始年龄在正常范围内,但通常较早,青春期进程正常,成年身高也在靶身高的范围之内。但是,如果过早阴毛初现之前有低出生体重(low birth weight, LBW),青春期开始较早,并快速通过,初潮年龄约提前8-10个月,成年身高比正常出生体重的过早阴毛初现女孩平均下降6.5cm(~1SD)。在一项研究中,LBW-过早阴毛初现女孩在12岁以前初潮的发生率是对照组的三倍((∼75%对∼25%)(图2)。青春期开始和进程的加速归因于高胰岛素血症的刺激作用,高胰岛素血症是一种LWD女孩和过早阴毛初现女孩的特征表现。这些结果有待于在多种族人群大样本得到证实。在男孩,尚缺乏对最终身高的纵断研究。
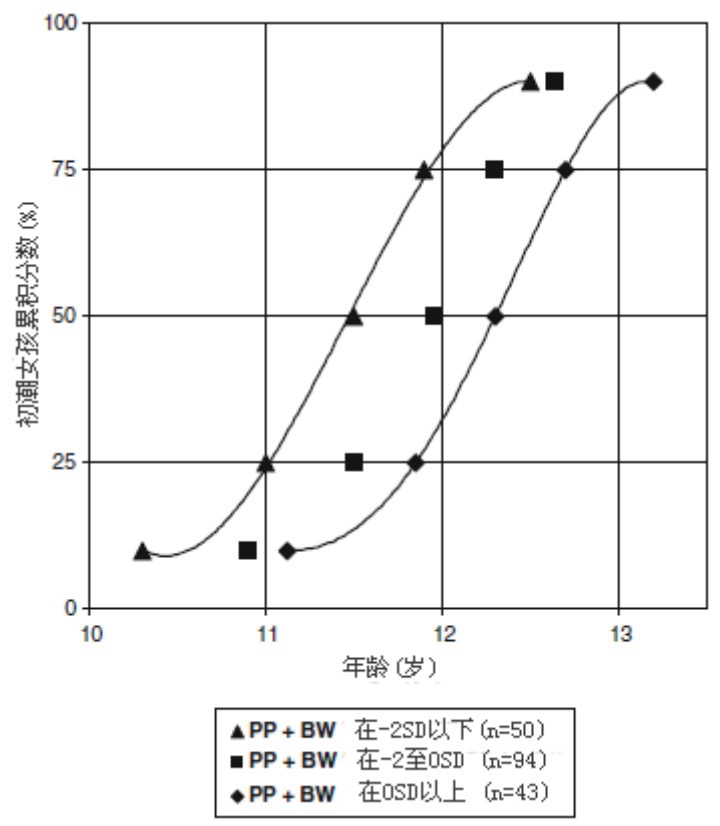
图2. 过早阴毛初现 (PP) 女孩不同出生体重亚组 (BW)初潮年龄的分布.
(低BW与高DW女孩初潮年龄p<0.001。平均初潮年龄12.8岁)
2.5 青春期后的追踪
过度肾上腺功能初现和过早阴毛初现的女孩具有青春期卵巢雄性激素过多症的高风险。这些作者后来证明,过早阴毛初现与青春期前、青春期中和青春期后的高胰岛素血症,低IGF结合蛋白1(IGFBP-1)的浓度,以及其它血脂异常、中心性脂肪过多和慢性炎症标志物变化的代谢综合症特征相关联。子宫内生长延迟与后来的高胰岛素血症和过度肾上腺功能初现有关,纵断研究资料揭示了由胎儿生长下降、儿童期体重赶上生长、过早阴毛初现直至青春期高胰岛素性雄性激素过多症的发生次序。
3 过早阴毛初现与代谢风险因素
3.1 胰岛素敏感性
过度肾上腺功能初现和过早阴毛初现的消瘦的加泰隆尼亚女孩,表现出高胰岛素血症,对一次口服葡萄糖负荷的胰岛素增长反应较早,外周组织对葡萄糖摄取增加,自由雄性激素指数[T (nmol/L)/SHBG (nmol/L)×100]升高,性激素结合蛋白(SHBG)和IGFBP-1水平下降。在诊断过早阴毛初现时这些特征已经出现,在青春发育期持续存在,似乎与雄性激素过多的程度相关。由稳态模型(HOMA)评价的空腹胰岛素敏感性以及口服葡萄糖耐受试验后(OGTT)胰岛素曲线下的面积,与已知的心血管风险因素,例如总胆固醇和中心性肥胖高度相关。在另一项研究中,几乎50%的过早阴毛初现的青春期前非洲黑人和加罗比海女孩,在多次静脉采样的葡萄糖耐受试验中,胰岛素敏感性显著下降。
北加泰隆尼亚血统的过早阴毛初现女孩一级亲属具有葡萄糖耐受损害和2型糖尿病的高风险,在女性一级亲属中也常见雄性激素过多症和妊娠糖尿病发生率的增长。
男孩过早阴毛初现的研究较少,而且研究结果不一致。例如,在不同种族的过早阴毛初现男孩的研究中,OGTT后胰岛素敏感性下降使循环SHBP降低和IGF-I浓度升高,而在北加泰隆尼亚血统的过早阴毛初现的消瘦男孩的研究中,发现上述参数与年龄、性别和BMI相匹配的对照组相似。
3.2 脂类特征和血压
由于过度肾上腺功能初现而过早阴毛初现的女孩,在青春发育期间,血清甘油三酯水平,以及低密度脂蛋白(LDL-C)/高密度脂蛋白(HDL-C)的比例增加。在横断研究中,过早阴毛初现女孩的收缩压和舒张压、总胆固醇(TC)、极低密度脂蛋白胆固醇(VLDL-C)、TC/HDL、LDL-C/HDL-C以及动脉粥样硬化指数显著高于相同人群的对照组。而在根据肾上腺功能早现(有或无过早阴毛初现)选择的女孩则大不相同,以身高别体重进行调整的血压和血脂水平与人群正常对照组相似。
3.3 身体组成
甚至在未超重或肥胖时,儿童的中心性脂肪和过多的内脏脂肪也与代谢综合症特征相关,包括异常的甘油三酯、LDL-C和HDLC,也与胰岛素抵抗相关。与年龄、体重指数(BMI)、青春期发身等级匹配的对照组女孩相比,过早阴毛初现女孩的腰围,腰围/髋比值,总的、躯干的和腹部脂肪量(以双能X线吸收法测定)均显著较高。腹部脂肪量与出生体重负相关,与雄性激素过多症的程度、空腹胰岛素和脂类水平正相关。过多的雄性激素似乎也解释了伴随的骨矿物质密度、骨矿物质含量和循环瘦素水平的增长。
3.4 炎症标志物
近来,已将脂肪组织看作为活性内分泌器官,它分泌多种生物活性因子,称为脂肪因子。这些蛋白可能具有局部或远端的炎性、免疫或激素信号作用,为脂肪组织与其它组织,例如肝脏和肌肉的代谢功能提供联系。
在所谓的促炎症细胞因子和促血栓细胞因子(pro-thrombotic adipokines)中有瘦素、白细胞介素-6(IL-6)和纤溶酶原激活物抑制因子-1(PAI-1)等。而循环的脂联素水平,特别是高分子量(HMW)的同工型,是与胰岛素敏感性正相关的蛋白激活形式,可能预防后来的2性糖尿病的发生。
高白血球和/或嗜中性粒细胞计数和嗜中性粒细胞/淋巴细胞比值也与卵巢雄性激素过多症妇女的低度慢性炎症和早期心血管疾病风险有关,也是心血管疾病和冠状动脉疾病死亡率的独立预测因子。
最近的研究显示,LBW-过早阴毛初现女孩通常有高嗜中性粒细胞计数,伴随以循环IL-6和总的、HMW脂联素的变化。高胰岛素性的胰岛素抵抗可能是这种白血球和脂肪细胞因子变化的调节因素,这些因子除与中心性脂肪有关以外,还可能与后来的心血管风险关联。与年龄、性别、发身等级相匹配的对照组相比,年龄较小的过早阴毛初现女孩循环PAI-1水平增高,而且与出生体重负相关,致使LBW的过早阴毛出现女孩有较高的PAI-1水平。青春期初期的PAI-1水平似乎可预测初潮后高胰岛素血症的程度。
4、青春期中的过早阴毛初现与高胰岛素性雄性激素过多症
4.1 过早阴毛初现与后来的肾上腺功能
在由儿童期开始跟踪的有过早阴毛初现史的青少年和年轻妇女,重估肾上腺功能显示,所谓的功能性肾上腺雄性激素过多症发病率增加,其肾上腺分泌物类似于过度肾上腺功能初现,但并无酶的异常。这种疾病已被归因于肾上腺细胞色素P450c17失调,主要发生在Δ5-通路上。在ACTH刺激后,55%的疾病患者表现超常(>平均数+2SD)的3β-羟类固醇、17-羟孕烯醇酮(17-OHPreg)和DHEA水平,其中50%也表现出Δ4-A和17-羟孕酮(17-OHP)的过多反应。基线DHEAS、Δ4-A以及在诊断为过早阴毛初现时ACTH刺激后的17-OHP都不能预测青春期肾上腺雄性激素过多症。只有低出生体重与后来的肾上腺雄性激素过多症显著相关,说明了出生前即开始的内分泌次序的可能性:出生时的低体重,儿童期的过早阴毛初现和青春期的肾上腺雄性激素过多症(图3)。

图3. 青春期有(n=16)和无(n=30)功能性肾上腺雄性激素过多症的过早阴毛初现的出生体重(SDS).
(FAH:功能性肾上腺雄性激素过多)
4.2 过早阴毛初现与后来的卵巢功能
某些作者指出,在儿童期曾诊断为过早阴毛初现的青春期开始前后和青春期后女孩,多毛症和卵巢多囊超声表现发生率增加。在一组27名初潮后的过早阴毛初现女孩中,有9名女孩多毛症得分增加,基础雄性激素水平增高,其中3名还有月经稀发和多囊卵巢超声表现。后来,对过早阴毛初现女孩的青春期后的跟踪发现,卵巢雄性激素过多—即所谓的多囊卵巢综合症(polycystic ovary syndrome,PCOS)的发生率增加10倍以上(45%对正常人群的3%)。这种实体似乎更多见于在诊断为过早阴毛初现时DHEAS和/或Δ4-A水平增高的女孩(图4)。
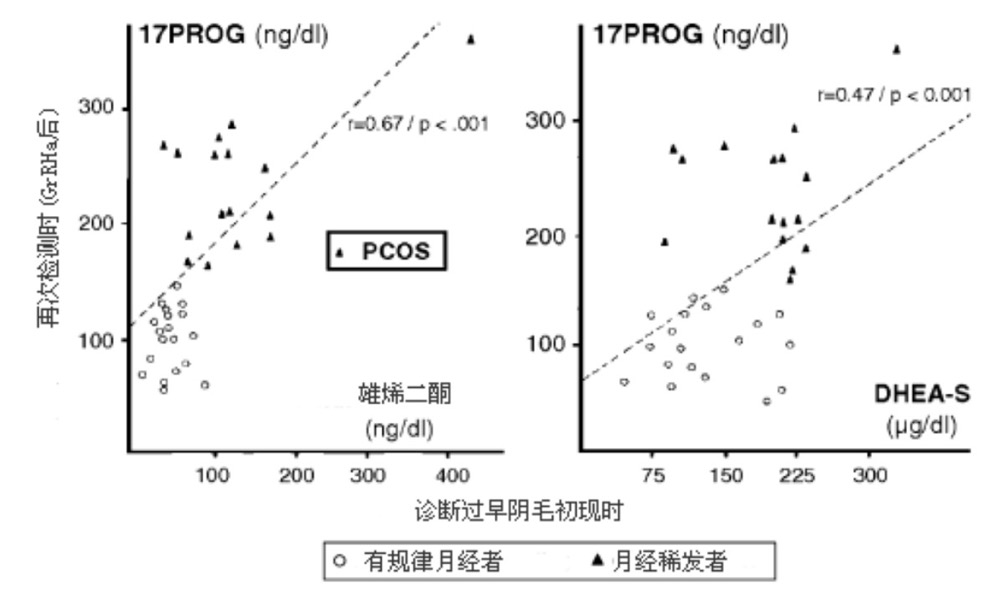
图4.在诊断为过早阴毛初现时基础脱氢表雄酮硫酸盐(DHEAS)和雄烯二酮(Δ4-A)水平与应用醋酸亮丙瑞林后17-羟孕酮(17-OHP)数值之间的关系. (PCOS:多囊卵巢综合症)
4.2.1 多囊卵巢综合症:病因学和病理生理学
PCOS是年轻女性最常见的与雄性激素过多有关的疾病,估计青少年和成年女性的发病率在3%。POCS的典型表现以无排卵的月经异常、肥胖、雄性激素过多、血浆LH浓度增高和多囊卵巢超声表现为特征。但是,PCOS仍然是有争议的实体,部分原因是对其发病机理的了解甚少,也由于两次共识会议后仍然未对诊断标准达成一致意见。相当大比例的综合症妇女不肥胖,没有典型的促性腺激素分泌异常,也未表现出POCS的超声特征。
PCOS病因学假设不断扩展了对这种综合症的了解。大部分人都认为,扰乱滤泡生成的雄性激素增高和高胰岛素血症是PCOS病理生理学的核心部分,由遗传和环境因素所启动。
例如,几项研究曾经分析了作用于PCOS病因的70余候选基因。其中有调节促性腺激素分泌、雄性激素生成和作用、胰岛素信号转导基因多态性变异体,以及引起糖尿病和肥胖的基因。例如,对编码胆固醇侧链裂解酶(P450scc)的CYP11A基因,染色体19p13.2(D19S884)二核苷酸重复标记定位进行了复制研究。某些研究在一个以上的人群,未能确立候选基因与PCOS性状之间的关联,这些基因包括编码(需)钙蛋白酶的CAPN10,和侧翼调控胰岛素基因(INS)的不同数量衔接重复多态性 (VNTR)。在PCOS,雄性激素受体(AR)基因的遗传性变型的作用和X失活得出了相矛盾的结果。几项研究证明,编码AR N-端转录激活域中多聚谷氨酰胺尾部的CAG重复长度与受体活性之间为负相关,因而对雄性激素的敏感性也如此。但在AR基因为X-连锁和X染色体单拷贝失活的妇女,X-失活方式影响AR活性,因此影响PCOS表型。
逐渐增多的证据提示,PCOS起因于子宫或是出生后的早期。这种观点得到了出生前给以超量雄性激素的动物模型的支持。妊娠雄性激素过多的时机是重要的,因为在胎儿器官发育的不同阶段的激素损害处理,表现出了不同的与PCOS有关的特征。在人类,遗传和环境因素可能引起出生前的雄性激素超量,并可通过外成作用而增强,随后靶组织的程序性分化朝向成年期的PCOS表型
滤泡生成异常和/或异常的内分泌环境曾被认为是与PCOS有关的排卵功能障碍的病因,卵巢内的雄性激素过多与高胰岛素血症一起可能促进卵泡过早生长,抑制滤泡选择过程,缺乏窦前和窦状滤泡的成熟,因此扰乱FSH引起的粒层细胞的分化。
多种因素的结合可能导致功能性卵巢雄性激素过多,这是一种以对GnRH激动剂刺激有独特卵巢17-羟孕酮过度反应为特征的实体,普遍可见于有过早阴毛初现和过度肾上腺功能初现史的非肥胖青春期女孩。目前认为这种实体是PCOS的一种形式。功能性卵巢雄性激素过多通常与高胰岛素血症和/或胰岛素抵抗有关,是对卵巢的主要作用因素,也通常伴随出现肾上腺雄性激素过多,同时出现过多的LH和雄性激素引起的孕酮对LH分泌的异常负反馈。
4.2.2 多囊卵巢综合症:诊断标准
普遍根据1990年四月国家卫生研究所(NIH)发起的专家讨论会汇编来确定PCOS,其定义如下:(1)临床雄性激素过多;(2)排卵过少;(3)已知疾病的排除。2003年五月在鹿特丹举行的另一次专家会议的定义为,在排除相关疾病后,具有下述3中特征中的两项:(1)少或不排卵;(2)雄性激素过多临床的和/或生化的征兆;(3)多囊卵巢超声表现。对后者标准存有争议,某些人认为,这是一种与出生前生长有关的早期开始的,而后来出现偶发症状的疾病。例如,在非肥胖的功能性卵巢雄性激素过多青少年中,LBW者出现多囊卵巢形态的风险较低(图5)。这些结果意味着,将多囊卵巢形态作为PCOS诊断标准将减少PCOS女性中低出生体重女性的比例,而引起对肥胖等风险因素给以更多的注意。此外,这些观察提示,存在有出现PCOS的不同路径。因此,产生了以多囊卵巢形态作为诊断PCOS是否适当的疑问。
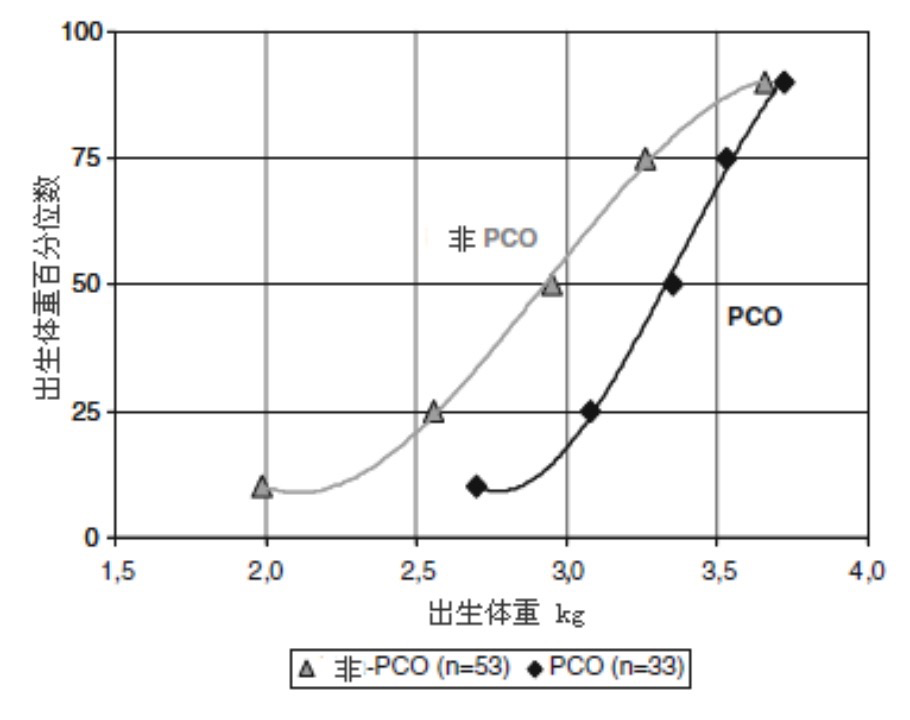
图5. 卵巢雄性激素过多的非肥胖青春期和青年妇女出生体重的分布.
无多囊卵巢的(PCO)病人出生体重较PCO病人低(p<0.0005); POC病人的出生体重分布类似于一般人群。
4.2.3 多囊卵巢综合症:X 综合症
PCOS与并发心血管疾病的风险增加有关。在PCOS妇女,几种已确任的心血管风险因素的发生率增加,例如,高胰岛素血症和葡萄糖耐受性、甚至在无肥胖时的腹部脂肪增长-特别是内脏脂肪的增长、血脂异常、高血压、内皮功能障碍和长期低度炎症状态。这些异常都是代谢综合症的表现,所以将PCOS归入这种疾病之中。腹部脂肪过多,内皮功能障碍和胰岛素敏感性的损害都与脂联素和其它脂肪因子的循环水平,以及炎症标志物,例如IL-6、肿瘤坏死因子α(TNF-α)、C-反应蛋白(CRP)和嗜中性粒细胞计数相关。胰岛素抵抗似乎是这些特征与冠心病相关联的关键因素。
4.2.4 过早阴毛初现和卵巢雄性激素过多症
女孩过早阴毛初现后,功能性卵巢雄性激素过多症出现之前存在一个正常阶段,有规律的月经周期,其持续时间为初潮后3-5年左右,在这个阶段中排卵功能可能已经恶化。在青春期前诊断过早阴毛初现时,对ACTH试验有高17-OHP反应的女孩不排卵的更为多见。
青春期卵巢类固醇分泌的研究显示,与年龄、Tanner发身等级和BMI相匹配的对照组相比,过早阴毛初现女孩有过度的卵巢雄性激素合成。在青春期的初期,即可检查出卵巢雄性激素过高反应性,但在青春期中、后期更为明显,表现为大部分类固醇前身物基础水平、峰值水平,以及对GnRH激动剂刺激的反应性增高的特征。这种表现形式类似于过度肾上腺功能初现对ACTH刺激所出现的典型肾上腺过高反应,提示了卵巢细胞色素P450c17 (CYP17)的异常调节。曾有人提出,可能在肾上腺和卵巢都存在CYP17表达或活性的增高。这种功能增强首先可在儿童期的肾上腺发现,以过早阴毛初现所显露,后来在卵巢更为明显,表现为功能性卵巢雄性激素过多症的临床和生化变化。在某些存在遗传或环境诱病因素的病人亚组,可能存在青春期后的CYP17调节的紊乱,导致功能性卵巢雄性激素过多症的典型临床和生化表现。
4.2.5 过早阴毛初现和卵巢雄性激素过多症:高胰岛素血症的作用
过早阴毛初现女孩在青春期前胰岛素水平就已增高,并持续于青春发育期而进入青少年期。高胰岛素血症与卵巢雄性激素过多程度和自由雄性激素指数相关,是肾上腺和卵巢过多分泌雄性激素的启动因素。胰岛素和IGF-I刺激培养的泡膜细胞-间质细胞的雄性激素生成,增强类固醇激素合成和人类肾上腺皮质细胞对ACTH的反应性。胰岛素也调节IGF-I和胰岛素样生长因子结合蛋白I(IGFBP-1)的作用,抑制人肝细胞系性激素结合蛋白(SHBG)的生成。
与胰岛素和雄性激素分泌和/或作用相关的遗传多态性可能进一步调节上述作用,例如,INS VNTR、雄性激素受体CAG重复多态性、芳香化酶受体单倍型、IGF-I受体的SNPs、胰岛素受体底物1(IRS-1)和PAI-1基因等。青春期前和青春期初期的肥胖额外增加了循环系中的前身物合成雄性激素,进一步增强了LH的分泌和卵巢雄性激素的生成。
4.2.6 低出生体重是过早阴毛初现、卵巢雄性激素过度症和高胰岛素血症相联系的标记物
最初发现,胎儿生长下降与老年非胰岛素依赖性糖尿病相关。后来,又发现胎儿生长下降与青春期前矮身高儿童的胰岛素抵抗,以及与青春期女孩肾上腺功能初现相关。
过早阴毛初现女孩出生体重SDS低于对照组女孩,那些后来发展成为功能性卵巢雄性激素过多症的过早阴毛初现女孩也有较低的出生体重,而且有显著高胰岛素血症的女孩出生体重最低(在口服葡萄糖后,血清胰岛素平均水平高于正常出生体重女孩的平均数+2SD)(图6)。
经测定过早阴毛初现女孩和对照组空腹血脂、脂蛋白和IGFBP-1浓度发现,在过早阴毛初现女孩中,青春期有血脂异常和低IGFBP-1女孩的出生体重SDS低于血脂、脂蛋白和IGFBP-1正常的女孩(p<0.0001),而处于异常数值与正常值中间的女孩出生体重SDS也在中间位置上。因此说明,血脂异常和低IGFBP-1的过早阴毛初现女孩与出生前的生长延迟有关。
因此,出生后的内分泌功能对出生后生长疾病调变的易感性不同。有显著肾上腺功能初现、卵巢雄性激素过多、血脂异常和高胰岛素血症的过早阴毛初现女孩可能都有共同的出生前起因,而不是儿童期后期或青春期才开始的直接因果关系。这种综合症的三项基础(低出生体重、过早阴毛初现和卵巢雄性激素过多)可用来鉴别发展过程中的其它标记事件:在中心性脂肪过多和瘦体重减少后,过早阴毛初现,伴随血脂异常和低水平SHBG、脂肪因子异常、高嗜中性粒细胞计数,然后较早出现快速青春期发身和初潮,和初潮后的肾上腺雄性激素过多和无排卵。
女孩纵断数据说明,青春期前或甚至初潮后还检测不出出生前生长延迟所引起的内分泌代谢风险,并且不能归因于较高的BMI。遗传多态性进一步调变内分泌-代谢表型,体重过大加剧表型或加速其显露。只有在掌握有无肥胖、高胰岛素血症或卵巢多囊超声表现的卵巢雄性激素过多症妇女的出生体重数据后,才能了解到这种途径的卵巢雄性激素过多症的真实发病率。
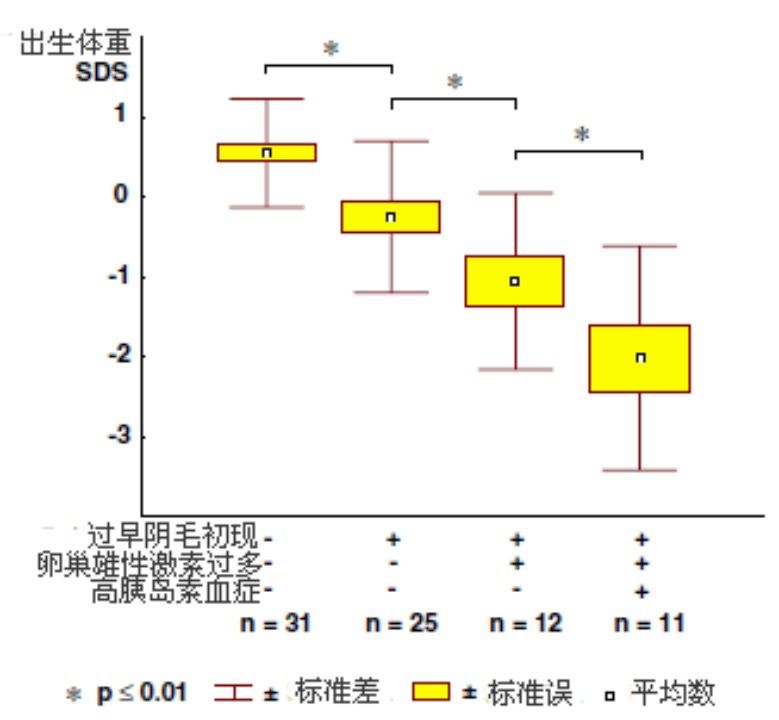
图6. 初潮后对照组女孩(―,―和―)、初潮后有过早阴毛初现和无卵巢雄性激素过多 (+,―和―)或有(+,+和-) 并无高胰岛素血症、以及有过早阴毛初现和卵巢雄性激素过多并有高胰岛素血症(+,+和+)女孩的出生体重.
5 过早阴毛初现:预防发展为卵巢雄性激素过多症和调整青春期进程的新疗法
在过早阴毛初现女孩,虽然低出生体重具有发展成为青春期卵巢雄性激素过多症的额外风险,但初潮后的初期阶段是高胰岛素血症、血脂异常、脂肪过多瘦体重降低出现扩展的关键时期。高胰岛素血症的胰岛素抵抗是关键的病理因素。
甲福明对胰岛素的敏化作用降低PCOS妇女的高胰岛素和雄性激素过多,恢复正常月经,提高自发排卵率;在过早阴毛初现的非肥胖青少年也观察到了相同的效果。在有低出生体重并以前消瘦,现已初潮后6-12月的有高胰岛素血症、雄性激素过多症、血脂异常、躯干和腹部脂肪过多、瘦体重下降、但无临床征兆或雄性激素过多症状的女孩,我们探索了预防性地应用胰岛素敏化作用来中断过早阴毛初现至PCOS的进程。这些女孩被随机分为接受甲福明(850mg/day)组和无治疗的对照组,未治疗女孩的胰岛素敏感性、血清雄性激素、血脂、总体和躯干脂肪和瘦体重与正常值的差距进一步加大,而甲福明治疗组的异常在6个月内发生了逆转,在6-12个月身体组成继续得到改善(图7)。只要停止治疗,大部分益处就将消失。后来,这些研究结果在同一人群的另一组低出生体重、过早阴毛初现女孩得到了复制。增加氟他胺仅有益于有更高雄性激素受体活性的遗传标记的女孩亚组。在处于PCOS风险的、有低出生体重的、青春期前的过早阴毛初现女孩,以甲福明(425mg/day)敏化胰岛素也对SHBG、Δ4-A、DHEAS、LDL- 和 HDL-胆固醇、甘油三酯、IL-6、脂联素、总体和腹部脂肪、瘦体重有正常化作用。
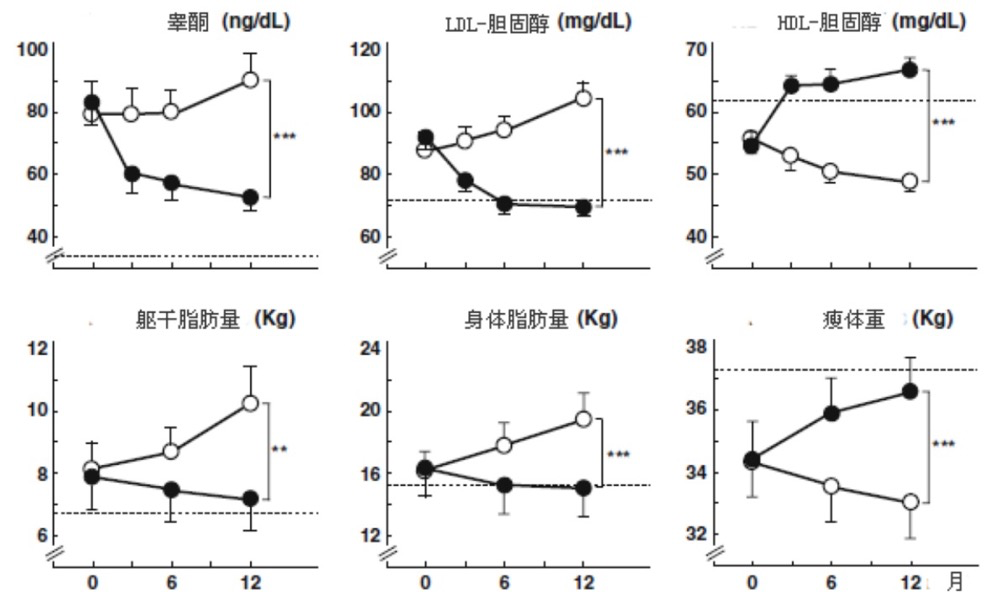
图7. 24名(平均年龄12.4岁)低出生体重、儿童期过早阴毛初现女孩的血清睾酮、
LDL-和HDL-胆固醇和身体组成指标.
随机分为治疗组(n=12, 850mg/day, ●)和对照组(n=12, ○); **p<0.005; ***p< 0.0001.
如前所述,有低出生体重史的过早阴毛初现女孩的青春期较早,并且进展更迅速,主要看低出生体重后是否出现出生后体重增长过多的赶上生长。即使在无躯干性肥胖的情况下,这种风险也似乎存在,因此,我们假设胰岛素抵抗造成了这种后果。所以我们又研究了过早阴毛初现诊断后(年龄~8岁)不久,开始以甲福明敏化胰岛素对延迟青春期发身的影响。甲福明治疗与体脂和血清瘦素水平下降有关,青春期发身开始延迟0.4岁,线性生长速度保持不变(图8)。4年后,与对照组比较,甲福明治疗女孩的脂肪增长较少,平均5.5kg(约50%),特别是腹部脂肪较少,胰岛素抵抗和雄性激素过多较轻,IGF-I水平和导致动脉粥样硬化的血脂水平较低,初潮后的水平也可能低于对照组。身高、瘦体重和骨矿物质密度的增长相似。这些作用的基本机理了解还甚少,可能部分为与甲福明有关的肌肉和肝脏中胰岛素敏感性的改善,部分为甲福明对卵巢类固醇生成的直接作用。
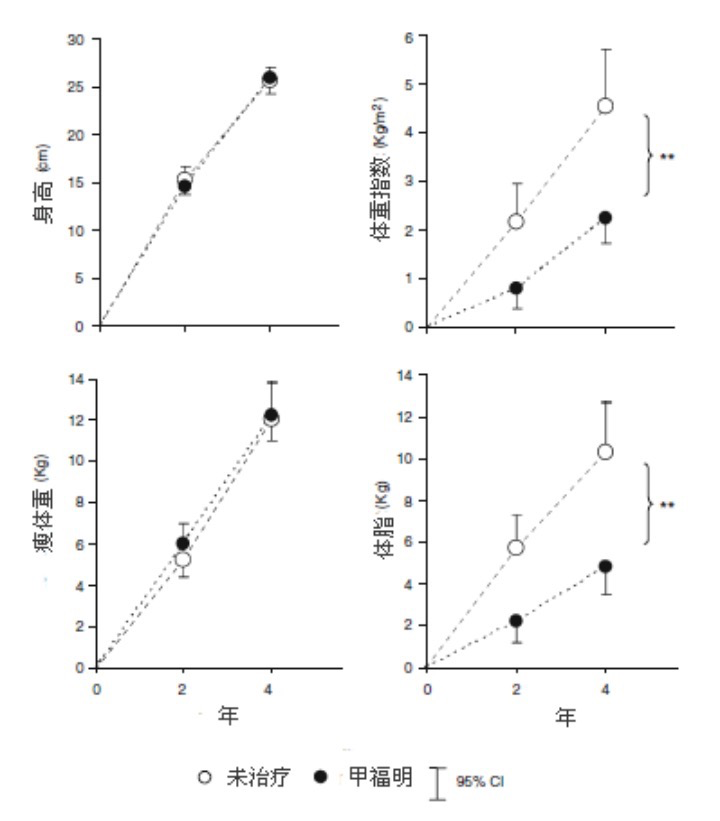
图8. 有低出生体重史的过早阴毛初现女孩身高、体重指数、瘦体重和体脂的增长.
随机分为对照组(n=19)和接受甲福明治疗4年(n=19); **组间纵断差异p<0.005.
6 结论
女孩过早阴毛初现不一定是正常现象,也就是说,并非简单肾上腺功能初现的较早出现。对这些女孩的长期跟踪结果,支持过早阴毛初现可能是代谢综合症的预兆,并出现于临床青春期卵巢雄性激素过多之前的观点。这种次序更常见于过早阴毛初现之前胎儿期生长降低而出生后身高和体重(主要地)过多赶上生长的情况。在这些女孩,青春期可能较早开始,进展更迅速,最终身高可能中等程度地降低。
以高胰岛素血症为关键因素的不利代谢环境可能使遗传性状(仍有待于完全确定)得以显现,诱导卵巢功能障碍,内分泌异常的演变进一步恶化这些代谢紊乱。
以前低出生体重的过早阴毛初现女孩,特别是高胰岛素血症者,应用甲福明治疗可逆转过早阴毛初现向临床雄性激素过多症发展的进程,正常化身体组成和过多的腹部脂肪,延迟青春期发身过程而不降低线性生长。这些结果提示,可以增高过早阴毛初现女孩中这个亚群的成年身高。但尚需长期跟踪这些病人,以完全确定胰岛素敏感化的最终效果,以及停止治疗后效果的保持。
【金骨龄】专业骨龄及生长发育研究机构,中国骨龄行业标准制定者张绍岩教授任首席科学家,致力于提供适合中国当代少年儿童的骨龄评价技术和生长发育评价服务,独立研发了适用于医疗、体育、司法及母婴行业的骨龄软件 !
【热门文章】

