摘要
努南综合症(Noonan syndrome,NS)是一种普通的临床和遗传异类疾病,以独特面貌、矮身高、胸腔畸形、先天性心脏病以及其它并存疾病为特征。在具有NS表型的个体鉴别出Ras/MAPK(丝裂原活化蛋白激酶)信号转导途径的基因突变,通常解释了~61%的病例。因此,NS常常是临床的诊断。因为临床表现的可变性和需要多学科的保健,所以疾病鉴别和综合处理非常重要。努南综合症支持组织(Noonan Syndrome Support Group,NSSG)是对NS受累病人提供支持、当前信息和理解的非盈利组织。NSSG召集了保健提供者会议,涉及了NS的各个方面,提出儿科医生诊断和处理NS的指南,并提出了更新的遗传学发现。
Pediatrics,2010,126:746–759.
关键词:努南综合症,PTPN11, SOS1, BRAF, KRAS, NRAS, RAF1, SHOC2,Ras/MAPK信号转导途径,先天性心脏病,矮身高.
缩写词
NS –Noonan syndrome,努南综合症;
CFC – cardiofaciocutaneous,CFC症候群;
MAPK - mitogen-activated protein kinase,丝裂原活化蛋白激酶;
LEOPARD –lentigines, electrocardiographic anomalies, ocular hypertelorism, pulmonary stenosis, abnormal genitalia, and deafness,色斑、心电图异常、眼距过宽、肺动脉瓣狭窄、生殖器异常和耳聋;
PTPN11 –protein tyrosine phosphatase non–receptor type 11 gene,蛋白络氨酸磷酸酶非受体型11基因;
PVS –pulmonary valve stenosis,肺动脉瓣狭窄;
GH –growth hormone,生长激素;
ASD –atrial septal defect,房间隔缺损;
HCM –hypertrophic cardiomyopathy,肥厚型心肌病;
MPD –myeloproliferative disorder,骨髓增生性疾病
努南综合症(Noonan syndrome,NS)是一种相对普遍的先天性遗传疾病,估计发生率为1/1000至1/2500活产婴儿。特征表现包括独特面貌、矮身高、胸腔畸形和先天性心脏病。这是一种具有完全外显率但表达可变的常染色体显性疾病。迄今为止,仅根据临床表现诊断,但已在~61%的病人鉴别出基因突变。因为确定NS诊断的困难,所以努南综合症支持组织协调召开了保健提供者和有关方面的专家会议,目的是提出诊断和处理指南。本报告是会议努力的结果,为儿科医生提供NS重要的临床特征,以及更新的遗传学病因和处理的建议(表1)。
NS的历史
在1962年,杰奎琳-努南,一名儿科心脏病专家鉴别出了9名面部特征显著相似、矮身高、胸腔畸形和肺动脉瓣狭窄的儿童。在1968年,发表了这9名儿童和其它10名病人的案例报告。为了承认Noonan的工作,采用了“Noonan综合症”的名称,因为是她最早指出,这种疾病在男女性别出现,与常染色体有关,包括有心脏缺损,并可能是家族性的。
临床描述和鉴别诊断
诊断NS最常用的依据是面部和肌肉骨骼特征。在婴儿期(图1)和儿童期的早至中期,面部特征最典型,在成年期更加难以识别(图1B)。NS新生儿头大,大头盖骨,小脸,高前额,窄下颊。双眼距离宽大,内眦赘皮,上睑下垂并睑裂水平或下垂(95%)。可能存在内眦距过宽和器官距离过远。鼻子短、宽,根部扁平。耳靠下、后旋,呈椭圆形,耳廓变厚(90%)。上唇与众不同,人中有深槽,高而宽的峰至上唇红(95%)和全唇。通常,颈短有过多的皮肤和低的后发线(55%)。在儿童期中期至后期,面部缺乏表情。类似于肌病个体的面部。到青春期,面部形状为倒三角形,前额宽大,逐渐缩小为尖下颏,眼睛特征不太显著。鼻根狭窄,细鼻梁,颈较长加重了蹼状皮肤或斜方肌的突出。虽然同一个体在婴儿期具有更为明显的特征,但成年面部可能是相当的寻常的。某些成年人有典型特征,包括眼睑下垂、宽眼距、低位耳并后旋和厚耳廓,蹼状颈。在年长的成年人,鼻唇沟比该年龄所预期的更突起,皮肤似乎透明且薄。
在幼儿期头发可能纤细,而在儿童期和青春期通常卷曲。无论年龄如何,眼睛通常为暗淡的蓝色或蓝绿色,在颜色上比家庭背景预期的要浅许多。在大部分个体可见胸腔的典型畸形-上部鸡胸和下部漏斗胸。也普遍可见奶头距宽和低位,以及园肩。在10%至15%的病人有脊柱侧弯。其它不普遍的脊柱异常有脊柱后凸,脊柱裂,椎骨和肋骨畸形以及膝外翻。在10%和15%病人出现马蹄内翻的畸形足,4%病人出现其它关节挛缩,2%的出现桡尺骨融合,2%的颈部脊骨融合。一半以上男性(10-11°)和女性(14-15°)病人发现前臂提携角异常(肘外翻)。普遍存在伸展过度。

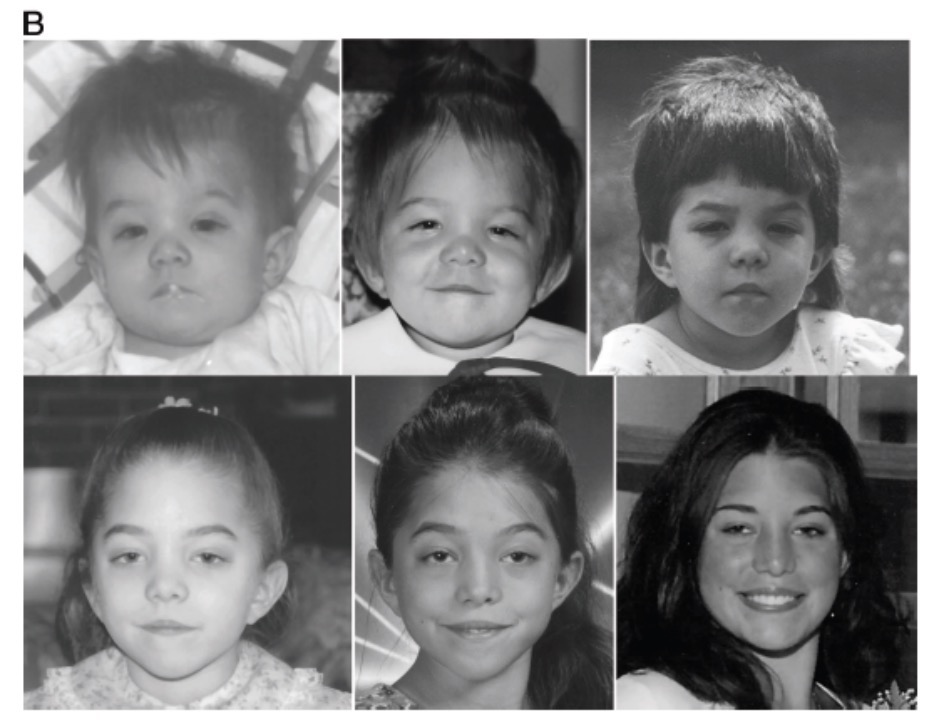
图1 A 在10天,6个月和2岁时的NS病人(有左至右);
B 在4个月和1,2,5,9和21岁时NS病人(有左至右)
因为预后、复发和治疗不同,所以准确的诊断非常重要。有几种疾病与NS存在显著的表型重叠,例如特纳综合症(表2)。许多年来,在我们了解他们的基础病因前,通常将CFC综合症(cardiofaciocutaneous,CFC)和科斯特洛综合症(Costello syndrome)与NS相混淆,特别是在新生儿期。这并不奇怪,因为这些疾病类似NS,是由Ras/MAPK(mitogen-activated protein kinase,丝裂原活化蛋白激酶)途径的基因突变所引起。与NS有显著表型重叠的其它疾病有1型神经纤维瘤,LEOPARD (lentigines, electrocardiographic anomalies, ocular hypertelorism, pulmonary stenosis, abnormal genitalia, and deafness)综合症,奥斯科洛(Aarskog)综合症,胎儿酒精综合症,镶嵌三体性22,Baraitser-Winter综合症。分子遗传学检测有助于NS与CFC、科斯特洛综合症、LEOPARD、1型神经纤维瘤和奥斯科洛综合症之间的鉴别。核型检查可将特纳综合症与镶嵌三体性22区分开来。
分子遗传学检测和遗传学研究史
1994年,大样本NS家族遗传的连锁分析确立了与第一个NS连锁的基因座,在染色体带12q22-qter,称为NS1。后来确定了遗传异质性。
在2001年,Tartaglia等鉴别出蛋白络氨酸磷酸酶非受体型11基因(PTPN11)的错义突变为NS的第一个分子学病因。通过在NS1临界区域内PTPN11的观察,以及PTPN11缺失小鼠模型的研究揭示它的蛋白产物SHP-2是心脏半月瓣胚胎发育的关键而由此发现。因为肺瓣膜狭窄(PVS)是NS的重要特征,所以这些研究者认为PTPN11是NS1中的首选候选基因。此外,Tartaglia等验证了SHP-2,一种蛋白络氨酸磷酸酶,在Ras/MAPK信号转导中有主要的正向调节作用,特别是在可能与NS所见的多种形态异常(例如,骨发育的成纤维细胞生长因子,身体生长的生长激素和胰岛素样生长因子)相关联的几种配体-受体复合物信号转导的下游。这些研究者的推理是正确的,因为在NS遗传的两个中等家庭中,他们观察到了以与NS1连锁方式的PTPN11错义突变,然后在少数散发病例和NS小家庭中观察到约一半的病人有另外的突变。
随后的分子学发现表明,类似NS表型的其它遗传综合症,Costello和CFC被证明不是等位基因。另一方面,LEOPARD综合症是PTPN11等位基因,突变解释了~90%的病例,特殊的突变,特别是Y259C和T468M仅普遍存在于LEOPARD综合症。对于PTPN11所不能解释NS的病人,其它Ras/MAPK基因突变可能是候选基因。HRAS突变被证明为Costello综合症的病因;而在CFC综合症有4个Ras/MAPK基因(KRAS, BRAF, MEK1,和MEK2)突变,由2006年至今,又鉴别出6个Ras/MAPK候选基因:KRAS, NRAS, SOS1, RAF1, BRAF, 和SHOC2。
NS的遗传学检测
目前可用的商用检测使用了不同技术(双脱氧核苷酸测序,变性高效液相色谱法,基于微阵列的寡核苷酸测序),这些检测基本上依据了引起NS基因编码区域和内含子边缘侧翼的错义或插入/缺失的存在。虽然在非常类似(或就是)NS表型的病人很少鉴别出全部染色体异常(中间缺失,重复,平衡易位),但在当时未建议对典型NS病例进行常规核型或拷贝数量分析,对于非典型病例或在神经认知受累特别严重时才予以考虑。
出生后的NS突变检测
表3汇总了2001年以来出生后突变检测受试者≥20名的研究。在解释这些数据时存在重大的局限性,包括有NS诊断临床标准的异质性、在不同年龄上出现的表型、病例混合的敏感性(在家族病例中PTPN11突变率几乎是散发病例中的2倍)。至今,在NS鉴别出的7个基因中的突变解释了61%的生后病例。因为所有的研究都采用了序列基因分型的方法,所以目前尚无存在一个以上变异的NS病例的报告。最近有1个中心介绍了基于微阵列的测序技术,可同时检测所有相关基因,所以对于发现某些NS亚组病人多点突变是有意义的。表1提示了个体基因分型的算法,在补充资料中提供了这种算法的基本原理及其出生后突变检测的讨论。
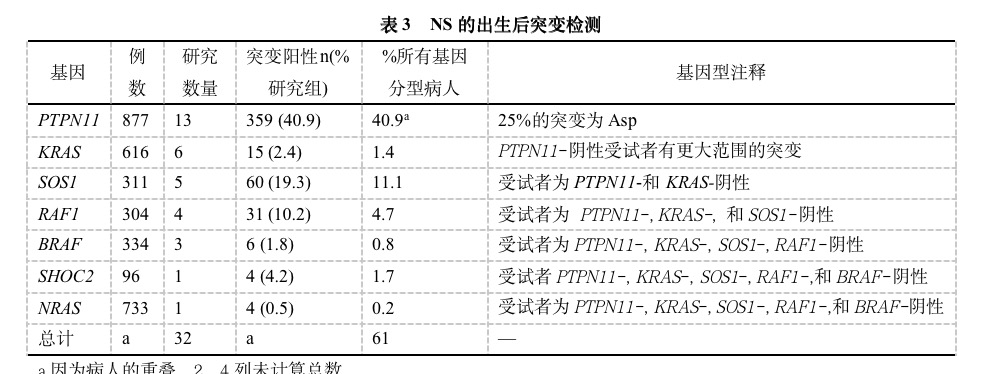
基因型/表型的关联
在NS突变基因中,报告了许多不同的基因型/表型的关系。在1基因型中未发现表型特征,可能是因为遗传的和外成的因素影响了外显率和表现度。表4汇总了可能对临床医生有用的基因型/表型关系,但要注意,对于特定基因型并无专一的表型。但是,基于致病基因的不同NS表现的风险存在显著差异。
PTPN11一致性的与胸部畸形、易瘀伤、典型的面部表现和矮身高表型相关。与SOS1相关的NS儿童更可能有CFC综合症样的皮肤表现(毛发角化病,头发稀疏、卷曲,眉毛稀少),矮身高或认知功能损害的可能性较小。PTPN11基因错义突变引起的NS病人更可能有PVS和房间隔缺损(ASDs),有肥厚性心肌病(HCM)的可能性低于无PTPN11突变的NS病人。致病病因为SOS1突变的病人,比既无SOS1也无PTPN11突变的NS病人更可能有PVC。值得注意的是,80%~90%的RAF1突变病人有HCM。SHOC2 S2G突变病人有独特的表型,最初称为Nooan样综合症,有松散的生长初期的头发。除了头发外,表型可能包括二尖瓣和室中膈缺损,生长激素缺乏,外胚层畸形(暗黑色鱼鳞癣皮肤),过重的鼻音和过度活动的发育问题。
一项45名NS病人的研究中,发现PTPN11突变病人特有的出血素质和幼年型粒单核细胞型白血病。NS家族病例比散发病例更易由PTPN11突变引起NS。归因于KRAS突变的NS似乎有更严重的表型,出现更显著的学习问题和发育延迟。
心血管问题
80%以上的NS病人有心血管系统的畸形,PVS最为普遍。25%~30%的PVS病人瓣膜发育异常,通常与ASD有关。单独的ASDs和部分性房室通道缺损也相对普遍。曾经报告了宽大的心脏畸形谱,如表5。约50%的NS病人有特殊的心电图模式,以左轴偏斜,左前区导联异常R/S,和异常Q波为特征。许多病人有轻微的PVS,仅需要定期的评估。如果PVS显著或有临床意义,开始治疗通常为肺部气球扩张术,但如果瓣膜发育异常,可能不成功。对于严重发育异常者,可能需要在儿童期进行肺瓣膜切除术或肺同种移植。其它的心脏缺损可以标准路线治疗。
20%的NS病人存在HCM,但RAF1突变的病人特别频繁,其严重性和自然史是可变的。某些HCM婴儿疾病得到缓解,而另外一些病人则可能迅速发展并有致命的结果。也有一些病人在婴儿期后显现,过程可能是稳定或进行性的,或是可能改善。这些病人的治疗与任何HCM病人相似,可能包括应用β受体阻断剂药物或外科肌瘤切除术,以减少流出道阻塞。
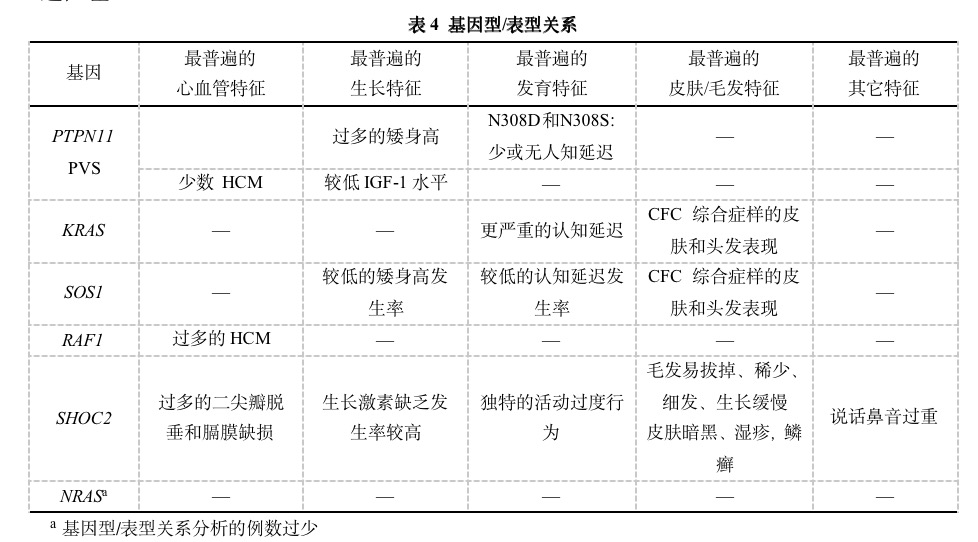
对于成年NS病人,重要的是终生的心脏追踪。在成年期可能出现左侧的阻塞病变。在早期肺瓣膜手术后,肺瓣膜不适和右心室的功能障碍是潜在的问题。在现有少数成年长期追踪报告中少见有心率失常。
生长和内分泌问题
生长
约50%~70%的NS病人矮身高。虽然矮身高是这种疾病的主要特征,但某些个体有正常的生长和身高。出生体重和身长正常,但随后身高和体重减速到3rd百分位数或以下。骨龄平均延迟在~2岁。已经发表有NS特定的生长图表。
欧洲NS病人的平均成年身高为女~153cm,男162.5和169.8 cm。北美NS病人中,54.5%女(<151cm)和38%男(<163.2cm)的平均成年身高低于3rd百分位数。PTPN11阳性病人矮身高的发生率高于突变阴性受试者。与SOS1相关的NS病人矮身高发生率较低。
关于GH分泌动力学的报告不一致,可能反映了NS的遗传异质性。曾有GH缺乏(45%,n =150;37%,n =27),神经内分泌功能障碍和完全正常的GH分泌报告。胰岛素样生长因子-1水平通常较低,PTPN11突变阳性病人显著低于突变阴性病人。
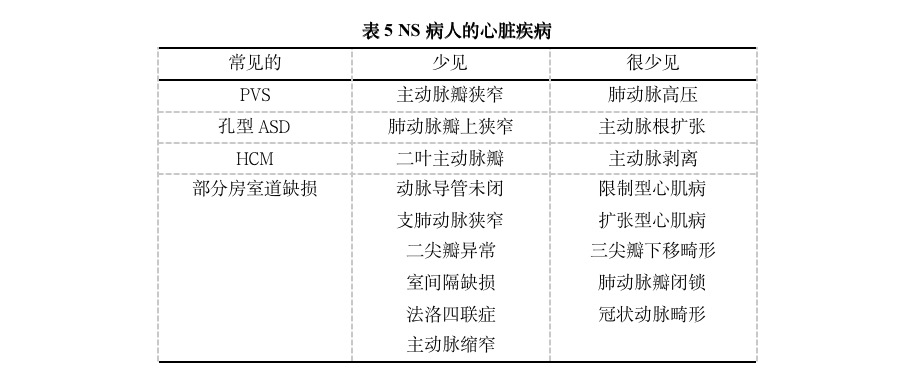
近来,一些研究报告了GH治疗NS的大部分经验,这些研究包括了不同登记年龄、治疗持续时间、剂量和反应的小样本病人,得出了改善生长速度而无重大副作用的结果。虽然大部分研究排除了HCM病人,但在测量以GH治疗的NS病人时,左心室壁增厚保持正常。此外,在结合6篇报告GH治疗NS成年身高结果文献中的889名病人中,仅有5项研究报告了心脏事件(2名PVS轻微发展,1名HCM,1名双心室肥厚增加,1名心脏代偿失调)。
通过成年身高数据可以估价GH治疗NS的效果(表6)。虽然在这些研究中报告了不同的参数(中位数与平均数,根据人群标准和NS特定标准的身高SDS,不同的剂量等),但如同其它疾病的治疗一样,如特纳综合症,较早开始治疗并持续较长时间似乎改善了结果(△SDS:1.3~1.7;平均身高增长:男9.5~13cm,女9.0~9.8cm)。
最初的短期数据提示,PTPN11阳性病人对GH的反应不如PTPN11阴性病人有效。与此相反,以GH治疗的PTPN11突变阳性与阴性病人成年身高的比较结果无差异。因此,尚需其它研究来澄清不同RAS/MAPK通道的异常在生长和GH反应中的作用。
其它内分泌和自体免疫问题
典型男女NS病人青春期延迟,但不是全部如此,以青春期生长突增减少为特征。男孩青春期开始年龄在13.5~14.5岁,女孩在13~14岁,并可能快速进展(<2年)。在男孩14岁和女孩13岁尚无第二性征出现,可开始青春期诱发(为了最佳化身高潜力要认真考虑开始时间)。
在NS病人普遍发现甲状腺抗体,但甲状腺机能减退可能并不比一般人群更多见。也存在出现其它自体免疫疾病的病例。例如系统性红斑狼疮和乳糜泻,但其发生率不清。
肾和泌尿生殖器问题
NS病人肾异常的发生率在10%~11%,但通常临床意义不大。已经报告了孤立肾,肾盂扩张和双重收集系统。在80%的NS男孩出现隐睾症,需要外科睾丸固定术。最近证据提示,男性生殖腺功能障碍的病因是塞尔托利细胞功能紊乱而不是隐睾症。在女性似乎不影响生育力。
血液学和肿瘤学问题
据报告,30%~65%的NS病人有出血疾患。虽然这种症状通常轻微,例如过多的瘀伤,鼻出血或月经过多,但外科手术的出血可能是大量的。已经报告了一些凝结因子的缺乏(单独的或联合的),血小板减少和血小板机能不良。常见活化部分凝血酶原时间上升,约25%的NS病人部分VI因子缺乏。出血症状与缺乏的程度不完全相关,许多其它凝固因子可能减少,其次最常见的下降是低XII因子和VIII因子活性。虽然XII因子缺乏可能延长活化部分凝血酶原时间,但并不引起临床出血。在血管性血友病(von Willebrand)可见低VIII因子水平,在一般人群这是一种普通的出血疾病。虽然NS病人的VIII和von Willebrand因子都降低,但对于NS病人中von Willebrand的发生率尚无准确估价。关于NS病人因子IX缺乏和因子II缺乏并可能贡献于出血风险的报告较少。
在NS病人,已经报告了血小板减少症和血小板功能障碍。血小板减少症的病因可能是多因素的,可能与巨核细胞减少而引起血小板生成缺陷有关,脾肿大可能也引起轻微至中等的血小板减少,超声检查发现~52%的NS病人脾肿大。脾肿大可能是单独的或是与肝肿大相关。在某些病人,可能由NS/骨髓及外骨髓增殖病(myeloproliferative disorder,MPD)引起肝脾大或脾肿大。
在单核细胞增多的白细胞增多症、血小板减少和肝脾肿大特征的NS婴儿,可见NS/MPD疾病。虽然NS/MPD临床表现类似于青少年骨髓單核細胞性白血病(juvenile myelomonocytic leukemia,JMML),但NS/MPD的婴儿似乎有良好预后。尽管有报告某些NS/MPD婴儿出现严重白血病,而这种疾病大多出现在出生最初几个月,在未治疗的情况下,1岁左右时保持稳定或得到改善。
无论躯体PTPN11和KRAS突变对恶性肿瘤出现的作用如何,在较大年龄的儿童和成年NS病人中癌的发生率并不高于一般人群。但是,需要进一步的研究来准确估价NS病人的恶性肿瘤风险。
神经学、认知和行为问题
NS病人的神经学、认知和行为问题了解甚少,且非常不同。认知问题和学习无能发生率增长,脑畸形和许多其它神经学问题的发生率增加。在151名NS病人的研究中,76%的病人喂养困难,94%的有视觉问题,50%的有关节/张力减退的运动过度(hypermobility),13%的有反复性癫痫发作,3%的有听力损失,3%的有外周性神经病。运动能力发展的平均年龄普遍延迟,在10个月时仅能够坐起,在21个月开始走路,31个月时能讲两个词的句子。其它的研究表明,84%的病人有某种神经学问题,中枢神经系统和脊髓结构畸形和变形频数相对较低,最普遍的缺陷是I型阿-基氏脑畸形(Arnold-Chiari malformation)和脑积水。头围平均数在50th百分位数;但是某些NS病人可能是小头或大头。
大部分NS病人有正常的智力,但10%至40%的病人需要特殊教育。甚至在智力正常的受试者中,智商比未受累的其它家庭成员低10分,或是低于一般人群1SD。在包括有NS的Ras/MAPK信号传导级联症状病人(包括NS)认知能力的异质性至少部分归因于个体受累的基因和基因突变类型,例如,SOS1突变和特定PTPN11突变与无或轻微认知延迟相关。
NS儿童笨拙、协调能力差、倔强、易激惹的比例较高。在成年NS病人已观察到身体形象问题,不良自尊、抑郁和社会机能不全的问题。目前,关于NS病人的心理学和精神病学特征的资料有限,很少发现精神病学问题。在一项112名NS成年人研究中的定性资料表明,病人报告了适应无能,但总体上有好或满意的生活质量。此外,大部分NS成年人仅完成中学学业,参加工作。
胃肠与喂养问题
大部分NS婴儿(75%)有喂养困难问题;曾经报告有喂奶时间延长的吸吮不良(15%)、很差的吸吮和缓慢吃奶伴再发性呕吐(38%),以及需要管饲≥2周的严重喂养问题(24%)。在某些喂养困难儿童的研究揭示了肠运动不完全和胃肠运动发育的延迟。普遍可见胃食管反流,并有几项旋转不良的报告。虽然体重增长不良可能持续到18个月,但生长迟缓期为自限式的。
口腔与牙科问题
发现NS病人的口腔问题包括,高腭穹(55%-100%)、咬合不正(50%–67%)、咬合困难(72%)和小颌(33%–43%)。某些NS病人出现下颌囊肿,类似于颌骨增大症。NS病人的这些病变病因以纤维基质中的多核巨细胞为特征,不易与颌骨增大症相区分。但是,这两种疾病的遗传是截然不同的;颌骨增大症个体为SH3BP2基因突变,而NS病人的巨细胞病变是PTPN11126和SOS1127突变。
淋巴问题
NS与普遍的淋巴腺发育疾病有关,表现于胎儿至成年期。所有NS年龄组淋巴腺表现的发生率不清,但估计为~20%。在婴儿期最常见的是外周淋巴水肿,在最初的几年中消退。青春期和成年期可能出现外周淋巴水肿。
其它类型的淋巴问题包括,水肿,乳糜性胸腔积液,乳糜胸,肺淋巴管扩张,肠淋巴管扩张,下肢淋巴管发育不全,胸腔淋巴管异常,胸导管发育不全或缺如,腹股沟和髂骨淋巴管发育不全,睾丸淋巴管扩张。这些疾病的治疗处理是困难的。
结论
本指南出自多学科NS研究和保健专家会议。我们的目的是为儿科医生提供新的信息和增加经验,促进正确的诊断和对NS病人提供最好的保健。考虑到NS是一种临床和遗传的不同类疾病,以先天性心脏病、独特的面部表征、矮身高以及许多其它潜在的共存疾病为特征,需要对病人进行多学科评价和定期追踪保健予以鉴别诊断。不仅在儿童期,而且在全部成年期的理想保健的许多问题无疑将仍然存在。因此,本指南的建议主要根据作者们的最佳判断和目前医学知识而提出。
【金骨龄】专业骨龄及生长发育研究机构,中国骨龄行业标准制定者张绍岩教授任首席科学家,致力于提供适合中国当代少年儿童的骨龄评价技术和生长发育评价服务,独立研发了适用于医疗、体育、司法及母婴行业的骨龄软件 !
【热门文章】

