摘要
目的:本研究目的为确定停止抑制促性腺激素(GnRHa)治疗后,在不同年龄诊断的性早熟女孩身高增长是否不同,并估价其对最终身高(FHt)的影响。设计:我们比较了115名女孩(22名在6岁前诊断;38名在6~8岁诊断;55名在8~9岁出现过早快速青春期,EFP) GnRHa治疗后过程中和FHt数据。受试者在Tanner2~3期至生活年龄11~12岁和骨龄12~12.5岁期间以GnRHa治疗。结果:尽管在停止治疗时有类似的骨龄,青春期恢复时间(0.6±0.7,0.5±0.7,和0.5±0.7岁)和初潮年龄(12.6±0.5, 12.6±0.6,和12.7±0.9岁)也相似,但年龄较小的中枢性性早熟(CPP)组与年龄较大CPP组(P < 0.05)和EFP组(P < 0.001)相比,由停止治疗到FHt的身高增长较大,至骺融合的时间较长。仅年龄较小的CPP组达到了停止治疗时预测的剩余生长的百分数(6.6±1.6%与6.7±1.6%),而年龄较大组和EFP组则显著较低(分别为6.2±1.6%与4.6±2.7% 和6.3±1.5%与3.6±1.5%),与停止治疗时预测的FHt相比,这两组的FHt受到了损害(P < 0.01和 P < 0.001)。结论:6岁以后诊断的性早熟女孩表现出较早的骺融合,治疗后身高增长减少,损害了FHt。因为所有女孩性腺轴的恢复相似,这种差异可能为治疗前生长板的内在变化。在这些女孩中停止治疗时剩余生长潜力的预测是不可靠的。
J Clin Endocrinol Metab, 2007, 92(9):3483-3489.
缩写词:
BA, Bone age, 骨龄;
BMI, body mass index, 体重指数;
CA, chronological age, 生活年龄;
CPP, central precocious puberty, 中枢性性早熟;
E2, estradiol, 雌二醇;
EFP, early and fast puberty, 过早快速青春期;
ER, estrogen receptor, 雌性激素受体;
FHt, final Ht, 最终身高;
GnRHa, GnRH agonist, GnRH激动剂;
Ht, height, 身高;
PFHt, predicted FHt, 预测的最终身高;
SDS, SD score, SD分值;
THt, target Ht, 靶身高;
Wt, weight, 体重.
前言
由于特发性中枢性性早熟过早的性类固醇激素暴露,引起骺生长板较早融合而损害最终身高(FHt)。近些年的许多研究中,发现GnRH激动剂(GnRHa)治疗保护了迅速进行性中枢性性早熟(CPP,8岁前青春期开始)大部分女孩的遗传身高潜力。但是身高的增长不同,年龄6岁以下诊断的CPP女孩有最有利的生长学结果,而在6~8岁诊断的女孩仅部分实现了生长的预测,8~9诊断的女孩GnRHa治疗对FHt无有益效果。
治疗CPP女孩的FHt结果一般归因于治疗前的初始特征,例如生活年龄(CA)、骨龄(BA),诊断时的身高以及治疗持续时间。但最近几年中,Oostdijk et al.和后来的Carel et al.报告,停止治疗时的骨龄和治疗后生长突增的程度也影响FHt结果,这些作者提出,在女孩BA 12岁后继续治疗FHt可能较低。根据这些研究,许多内分泌门诊的治疗策略为,不管是早诊断(<6岁)的还是晚诊断(6~8岁)的,都在CA 11~11.5岁和BA 12~12.5岁停止治疗,这是方法预期所有治疗女孩有类似的剩余身高增长的百分数(以Bailey 和Pinneau方法预测)。
在以前的研究中我们证明,与63名未治疗女孩相比,63名EFP女孩的GnRHa治疗减慢了青春期的进展,但总青春期生长未增加。而且,治疗后的身高增长也低于停止治疗时的预测。在本研究中,我们回顾分析了GnRHa治疗115名性早熟女孩停止治疗后的身高增长和FHt,这些女孩在建议的CA和BA上中断治疗,并与预测的治疗后身高增长和预测的FHt比较。我们的目的是,确定不同年龄上诊断的性早熟女孩治疗后身高增长与停止治疗时的预测是否不同,并估价治疗后生长对FHt的影响。
病人和方法
病人
回顾1980~2005年我们内分泌门诊主治的115名特发性中枢性性早熟女孩病例档案。其中60名女孩在8岁前出现青春期征兆(乳房和/外生殖器Tanner2期,有或无阴毛出现;22名在6岁前诊断,38名在6~8岁诊断),55名为EFP,其定义为8~9岁出现青春期症状并快速由Tanner2期转变为3期,而且伴随以近期生长和骨龄的加速。所有女孩符合下述进入研究标准:实验室检查结果符合于青春期中期(对GnRH刺激试验血浆LH反应>7mU/l);骨盆超声结果子宫大小和卵巢体积增加;在CA 11~11.5岁和BA 12~12.5岁停止治疗;在青春期定期追踪并达到了FHt。排除标准为早产和小于孕龄儿女孩、以及患有慢性疾病、骨发育不良、器质性脑病变、先天性肾上腺增生,或放射学治疗和/或化疗引起的其它内分泌异常。
本研究方案得到拉宾医学中心学会评审委员会批准。
过程
根据我们门诊当时的策略,对所有8岁前诊断为进行性CPP女孩给以抑制促性腺激素治疗,以及对有心理问题的EFP女孩给以延迟青春期治疗。治疗在Tanner 2或3期开始,每4周肌肉注射储库型超活性的GnRH类似物—曲普瑞林(达菲林),每天释放1.5~3.0ug/kg的剂量。体重低于30kg的女孩剂量较小,但根据体重增长而增加,至3.75mg的最大剂量。所有女孩的治疗在2年以上,均有青春期受到抑制的证据数据。在大部分受试者的治疗中,测定了基础的和刺激试验后的LH、FSH峰,以及基础雌二醇(E2)。
在CA 11~11.5岁和 BA 12~12.5岁,和/或生长速度下降至4cm/yr以下时停止治疗。
追踪
对所有女孩治疗后至少追踪3~4年。当乳房发育Tanner分期发生进行性变化时,临床确定为青春期恢复。以4~6个月的间隔检查身高(ht)、体重(Wt)、青春期发育分期,记录初潮年龄。每12个月评价一次骨龄。在达到青春期水平前,每12个月间隔测定血LH、FSH、E2和肾上腺雄性激素水平。
计算停止治疗与骺融合(BA = 15岁)之间的间隔-治疗后的生长期,停止治疗到FHt(BA>15岁且生长速度<2.5cm/年)的身高增长—治疗后的身高增长。
治疗后身高增长占达到的FHt的百分数与停止治疗时预测身高增长的百分数(100%减停止治疗时成年身高的百分数,根据Bailey和Pinneau预测表)进行比较。身高增长也与治疗后预测的身高增长比较,即停止治疗时预测的FHt(PFHt)与达到的身高差值。FHt与停止治疗时的PFHt和遗传靶身高(THt,修正的父母身高中值)比较。由同一小组(儿科内分泌医生、放射学医生和护士)完成所有的临床和放射学评价。
方法
Ht以Ht SDS表示,并根据疾病控制和预防中心的建议计算所有女孩及其父母的Ht SDS。体重以体重指数(BMI)表示,并计算BMI SDS。根据Marshall和Tanner方法确定青春期分期。使用Greulich和Pyle方法评价BA。根据Bailey 和Pinneau方法计算PFHt。根据Tanner et al.方法计算THt,其范围确定为THt±0.5SD。
如以前所报告,使用我们医院内分泌实验室的标准方法测定所有激素(基础的和GnRH刺激的LH和FSH,以及基础E2和雄性激素水平)。血清E2使用标准的RIA方法,检测限度5pg/ml。
由一名有训练的放射学医师进行腹部和骨盆超声检查。
统计学分析
使用BMPD程序软件分析所有数据,结果以平均数±SD表示。组间比较使用ANOVA,应用ANOVA重复测量检验预测的与实际达到身高之间的显著性。计算Pearson相关,应用多元回归分析确定停止治疗后的生长以及FHt的最好决定因素。P 0.05为显著性水平。
结果
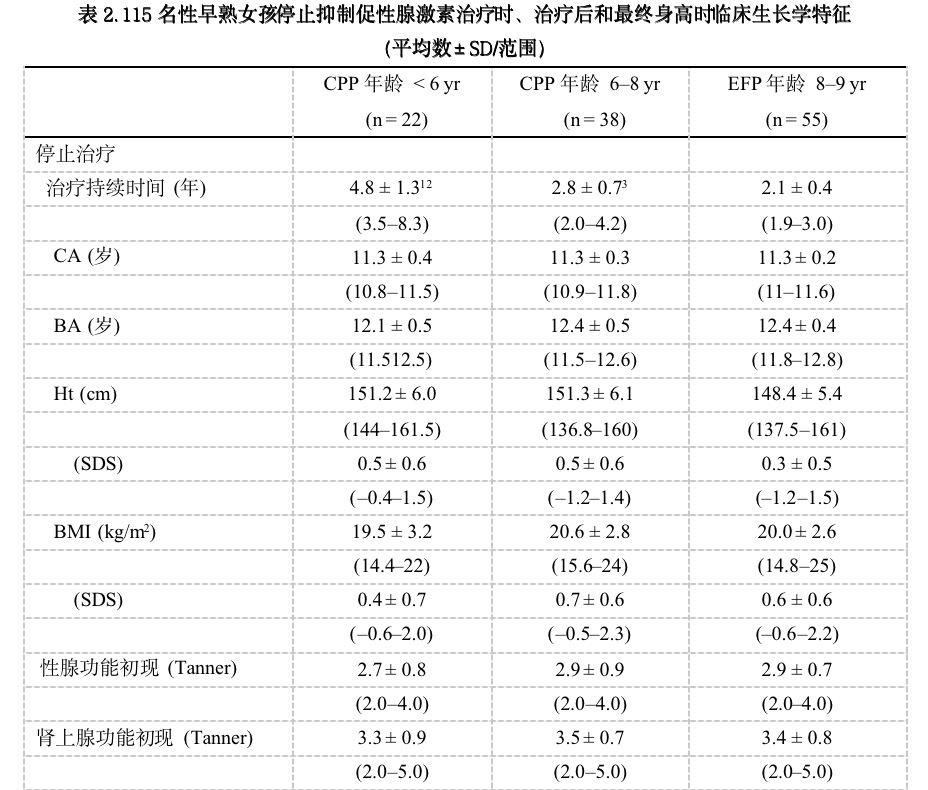
表1和表2为病人临床数据。
表1为诊断时和开始治疗时的病人特征。所有女孩临床症状与开始治疗之间有6个月至1年的间隔,这是由于由初级门诊转诊到我们三级治疗中心时间上的延迟,组间无显著性差异。
如所预期,与EFP组相比,6岁以前和6~8岁组诊断和开始治疗的CA和BA显著较低(分别为(P <0.001和P < 0.05),而三组平均骨龄提前(BA-CA)相似。前两组女孩(6岁以前和6~8岁诊断组)的身高高于EFP组(P < 0.001),但三组女孩开始治疗时预测的FHt相似。BMI组间无显著性差异。所有女孩开始治疗时的性腺功能初现分期相似,但6~8岁和8~9岁诊断组女孩的肾上腺功能初现分期比6岁前诊断更提前(P < 0.001)。诊断时的LH、FSH和基础E2水平无显著性差异。
治疗过程中,所有女孩性腺功能初现临床症状迅速停止,Ht-SDS和骨成熟速度同时下降。肾上腺功能初现临床症状以预期的速度进展。在所有检测的女孩,基础LH和FSH为青春期前水平并在GnRH刺激后未出现反应,在治疗期间E2水平不可检测。
表2为停止治疗时、治疗后和达到FHt时的临床生长学参数。EFP组的GnRHa治疗持续时间显著短于6岁以前诊断组和6~8岁诊断组(P < 0.05)。所有组病人在类似CA和BA上停止治疗,这时的平均身高、BMI和青春期分期(性腺功能初现和肾上腺功能初现)相似,停止治疗后的青春期恢复和初潮出现年龄也相似。停止治疗1年后,基础LH、FSH、E2水平由接近或低于可检测水平上升高Tanner 4-5期的正常范围,所有女孩的雄性激素水平也在符合于Tanner 5期的正常范围之内。尽管停止治疗时的BA相似,但EFP女孩的的骨成熟速度较快,导致较早的骺融合和较短的治疗后生长期(P < 0.001),停止治疗至FHt的身高增长也显著较低(P < 0.001)。虽然三组女孩的THt差异无统计学显著性,但EFP组的THt与FHt差值显著大于两CPP组(P < 0.001)。

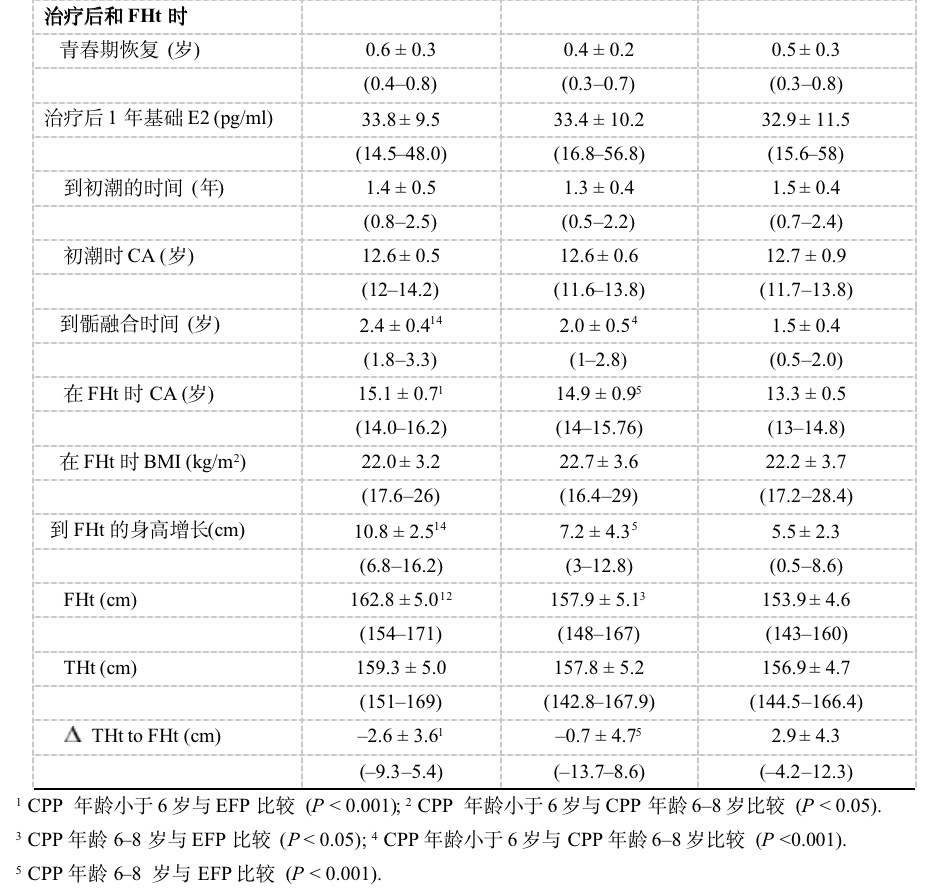
包括所有参数的逐步多元回归分析显示,4个参数解释了停止治疗后Ht增长的80%:治疗后的生长期(R2 = 0.44),停止治疗时的BA(R2 = 0.53),停止治疗时的Ht-SDS(R2 = 0.57)和青春期开始时CA(R2 = 0.64)。
表3为停止治疗时预测的Ht增长和FHt与实际到的Ht增长和FHt的比较,以及THt与FHt的比较。因为所有女孩在停止治疗时的BA相似,所以三个组的成年身高百分数相似,但是,仅在6岁前青春期开始组女孩,由这点开始到FHt的剩余生长与预测的身高增长相类似,其余两组女孩,Bailey-Pinneau方法高估了治疗后的身高增长。只有6岁前诊断的女孩达到了治疗停止时预测的最终身高(PFHt),6~8岁组和EFP组女孩未达到她们的PFHt(分别为P < 0.01 和P < 0.001)。
图1为达到的FHt与治疗开始和结束时预测的FHt,以及THt的比较。6岁以前组和6~8岁诊断组女孩所达到的FHt显著高于治疗开始时的PFHt (两组均为P < 0.001)。EFP组女孩达到的FHt仅稍高于治疗开始时预测的身高(P = 0.06)。当与达到的FHt相比,所有女孩在治疗开始时预测的FHt都未受到损害,只有6岁前诊断组女孩达到了治疗停止时的PFHt,而且这些女孩的FHt超过了THt(P = 0.013);6~8岁诊断组女孩未达到PFHt(P < 0.01),但FHt在THt范围之内;EFP组女孩即未达到PFHt(P < 0.001),也未达到THt(P = 0.015)。
将这些组群作为整体分析,发现FHt与停止治疗到FHt的Ht增长之间(r = 0.32, P < 0.02)、与FHt之前的治疗后生长期之间(r = 0.35, P < 0.01) 、与青春期开始时Ht之间(r = 0.75, P < 0.001)和与停止治疗时的Ht之间(r = 0.83, P < 0.001)都存在正相关。而在FHt与青春期开始的CA和BA之间负相关(两参数r = –0.47, P < 0.001)。FHt与开始和停止治疗时的BMI、治疗过程中的BMI、停止治疗时的CA和BA、至青春期恢复或初潮年龄的间隔、青春期开始或停止治疗后1年时的E2水平均不存在线性相关关系。
逐步多元回归分析表明,6种因素解释了FHt的88%:停止治疗时的Ht-SDS(R2 = 0.58),停止治疗时的骨龄(R2 = 0.62), 靶身高(R2 = 0.69),青春期开始时CA(R2 = 0.73), 治疗后生长期(R2 = 0.75),青春期开始时的Ht-SDS(R2 = 0.78)。
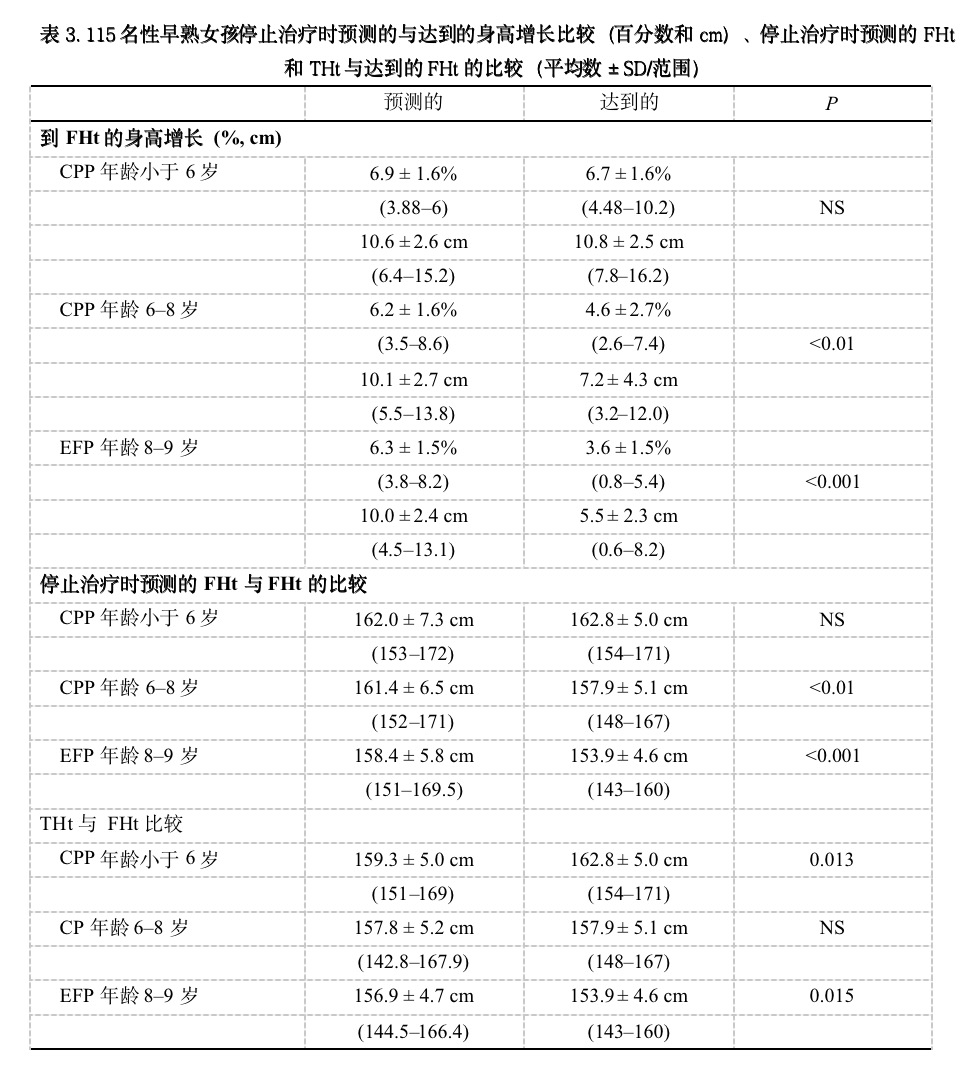
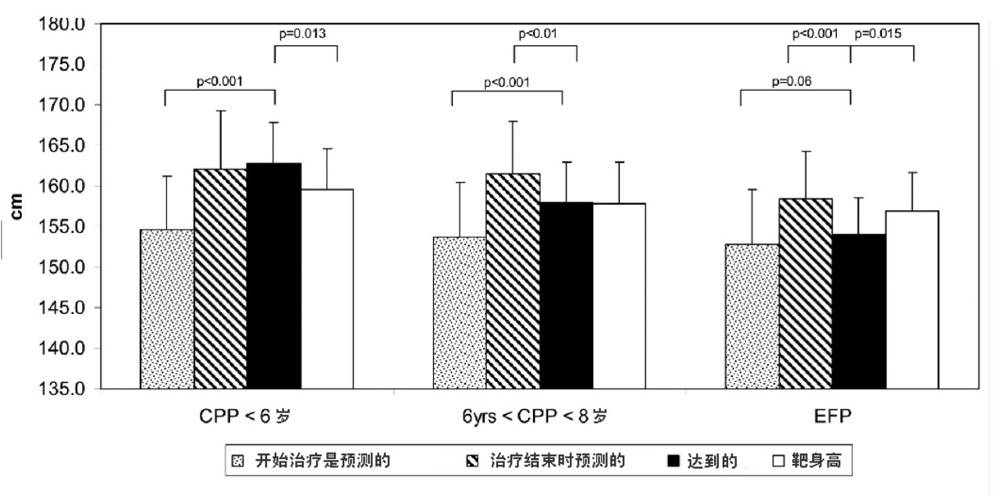
图1. 115名性早熟女孩达到的FHt与治疗开始和结束时预测的FHt的比较
讨论
为鉴别影响GnRHa治疗EFP女孩FHt的因素,已经进行了许多研究。Oostdijk et al.和 Carel et al.关于停止治疗的最佳时间问题的研究报告,在CA 11岁和骨龄12~12.5岁时停止治疗剩余生长能力最大。在本研究中我们发现,尽管停止治疗年龄相似,但EFP组女孩治疗后剩余生长显著少于8岁以前诊断的女孩(P < 0.001)。考虑到青春期开始年龄,治疗后身高增长的分析显示,仅在6岁前青春期开始女孩达到了预测的身高增长,而6~8岁和8~9岁青春期开始女孩治疗后生长受到损害(表3)。因此,我们的数据强调了青春期开始年龄与治疗后身高增长之间的关系。
可能影响治疗后身高增长因素的分析显示,停止治疗到骺融合的时间间隔所反映的骨成熟速度解释了逐步多元回归分析结果方差的67%。虽然我们研究中所有病人在相似的BA(11.5~12.8岁)上停止GnRHa治疗而得到了类似的剩余身高增长的百分数,但是EFP女孩加速的骨成熟速度缩短了治疗后的生长期(表2),很可能因此而减少了治疗后的身高增长。
与正常青春期一样,CPP的BA提前受到E2水平升高的调节。EFP女孩骨成熟加速的可能解释为,停止治疗后E2水平升高较早。但是,我们研究中所有女孩至青春期恢复和初潮年龄的时间相似说明了下丘脑-垂体-性腺轴的恢复类似,而且,停止治疗后1年时的E2水平无显著性差异。因此,EFP女孩治疗后身高增长的减少可能与E2水平无关。
肾上腺雄性激素作用于EFP女孩治疗后骺生长板成熟加速似乎也不可能。虽然在初始评价时,EFP女孩与6~8岁诊断组一样,肾上腺功能初现处于Tanner 2-3期,而6岁以前诊断组女孩仍然处于肾上腺功能初现前,在GnRHa抑制性腺功能初现过程中肾上腺功能初现的正常进展使所有女孩在治疗结束时达到3-4期。而且,在停止治疗到FHt期间,这些女孩都未表现出高雄性激素血症的临床征兆,雄性激素水平符合青春期5期的正常范围。
超重与骨龄提前之间存在非常确实的相关关系,体脂作用于骨成熟的加速和较早的性成熟。这些现象与超重儿童瘦素和胰岛素水平的升高和脂肪组织芳香化酶活性引起雄性激素向雌性激素转换的增加有关。我们的病人在青春期初期确实有少许超重,在全部治疗期中BMI-SDS增加,但与Boot et al.和Palmert et al.的研究不同,我们未发现治疗期间EFP女孩体重的显著增长。停止治疗前、后三组女孩的BMI-SDS相似。
因为全部组群中停止治疗后的激素环境相似,所以EFP女孩至FHt之前剩余生长的差异似乎反映了生长板的内在因素。根据衰老的理论,骺融合和生长停滞前细胞分裂数量已被预先确定,并随年龄而下降。在开始治疗时,EFP女孩年龄显著大于6~8岁和6岁前青春期开始女孩(分别为P < 0.05和P < 0.001)。因此,可以假设,EFP女孩甚至在开始治疗前生长板内软骨细胞的增生潜力已经下降。已经有研究发现,雌性激素暴露引起生长板过度衰老,这种影响受到两种雌性激素受体,ERα和ERβ的调节,雌性激素引起骺融合主要通过ERα的激活,而ERβ则作为ERα的负向调节因子而发生作用。最近,Nilsson et al.发现青春期发育过程中ERß阳性软骨细胞的百分数随年龄而下降。在我们的EFP组中ERß的下降比其它CPP组更显著,因而在开始治疗前以及停止治疗后EFP女孩生长板中的ERß表达已经下降,导致ERα的较早激活,加速了生长板的融合。
有人提出,决定剩余生长潜力的生长板衰老可由BA来间接评价。在本文中我们证明,尽管所有女孩停止治疗时有类似的BA,但只有6岁前青春期开始女孩达到了停止治疗时预测的FHt(P = NS);6~8岁和8岁以上青春期开始女孩的FHt显著低于PFHt(P < 0.01和P < 0.001,表3)。因此,因为停止治疗时的身高预测是不可靠的,所以BA未能反应剩余生长潜力,不能作为生长板衰老的替代标志。
可能出现的问题是,抑制EFP女孩青春期是否改变了治疗后BA增长速度,因而损害了治疗后的生长。如前言所述,我们以前的治疗与未治疗EFP女孩的比较研究表明,虽然GnRHa减慢了青春期速度,但既未改变总青春期的生长,也未损害FHt。
本文数据说明,6岁前青春期开始女孩的治疗得到了确证,但治疗对较大年龄性早熟女孩的FHt无效果。尽管如此,性早熟的心理学问题是不能被忽视的。
如果在BA 11岁而不是12岁时停止治疗,使病人有更充分的治疗后生长突增,FHt的结果可能要更好一些。这一点值得进一步研究。
最后,尽管所有治疗女孩停止GnRHa治疗年龄相似,并青春期恢复的临床和生物化学表现类似,但只有6岁以下诊断的CPP女孩达到了治疗后预测的身高增长和PFHt。EFP和6~8岁CPP开始女孩的剩余生长显著下降,这两组女孩骨成熟速度的加速和骺较早融合很可能由更成熟的生长板内在因素所致,损害了治疗后生长和FHt。因此,在停止治疗时对这样女孩的FHt预测是不可靠的。
【金骨龄】专业骨龄及生长发育研究机构,中国骨龄行业标准制定者张绍岩教授任首席科学家,致力于提供适合中国当代少年儿童的骨龄评价技术和生长发育评价服务,独立研发了适用于医疗、体育、司法及母婴行业的骨龄软件 !
【热门文章推荐】
在促性腺激素释放激素类似物(GnRH)治疗性早熟过程中生长的决定因素

